
发布时间:2013-03-28
附件:疝修补补片产品注册技术审查指导原则(2013年第7号).doc
一、前言
本指导原则旨在为食品药品监管部门对注册申报资料的技术审评提供技术指导,同时也为申请人/生产企业进行疝修补补片的注册申报提供参考。
本指导原则系对疝修补补片的一般要求,申请人/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。

本指导原则是对申请人/生产企业和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规和标准的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围
本指导原则所涉及的疝修补补片是指植入体内以修补疝的补片类产品,材质涵盖聚丙烯/聚酯/聚四氟乙烯/聚偏二氟乙烯等不可吸收合成材料、聚乳酸/聚己内酯等可吸收合成材料、动物源性材料、同种异体材料、复合材料等。
三、注册申报资料要求
(一)产品的技术资料(适用于首次注册及变更重新注册中的相关部分)
1.产品名称:产品通用名称一般为“疝修补补片”。
2.注册单元划分,可考虑划分不同注册单元的情况举例:
(1)不同的材质或化学成分;
(2)不同的适用范围,如:按照补片放置在腹腔内或腹腔外。
下列情况适合补片放置在腹腔内:补片置入腹腔内的腹壁疝(手术切口疝、造口疝、脐疝、白线疝、半月线疝等)、食管裂孔疝、膈疝、盆底疝等。
下列情况适合补片放置在腹腔外:补片不置入腹腔内的腹壁疝(手术切口疝、造口疝、脐疝、白线疝、半月线疝等)、腹股沟疝、股疝等。
3.产品适用范围:申请人应根据临床资料规范申报产品的适用范围,如描述为“该产品适用于腹腔外修补腹壁疝”, 或者直接描述其诊断名称,如:“该产品适用于腹腔外修补脐疝”。
4.产品基本信息:
(1)材质:申报产品各部件对应材质的标准化学名称(列表详述)。
(2)外型结构描述及相应图示:产品整体结构示意图、局部细节示意图(如编织方式、孔隙结构、分层结构图示)。对于由多个部件组成的产品,应提供每一组成部分的结构描述及相应图示(例如支撑环、提拉带、置入工具等)。
图示举例一:
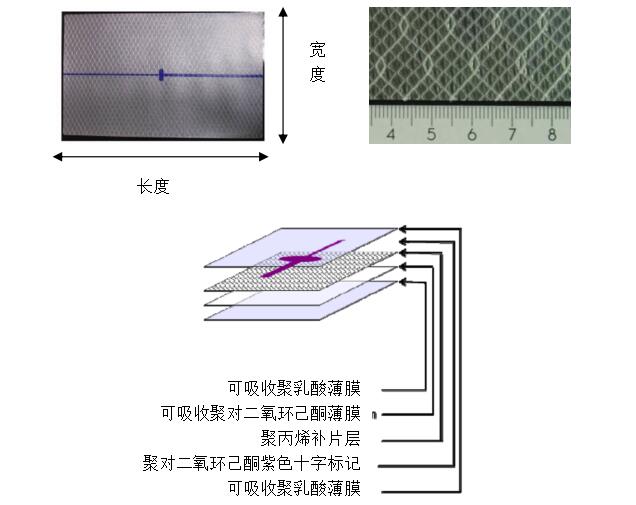
图示举例二:

(3)产品基本信息示例:形状(矩形平片、椭圆形平片、立体三维结构等);尺寸(长度、宽度、厚度、单丝直径、孔尺寸、网孔密度/网孔比例/孔隙率等);编织与加工技术描述(双纤维交替编织等);多层补片各层间连接方式描述(超声热合、缝合等);单位面积重量(g/m2),对于部分可吸收产品还应明确不可吸收部分的单位面积重量(g/m2)。
......

站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。
ONE-STOP SERVICE
免费赠送3万家医疗器械企业名录