
发布时间:2020-12-17
引言:10月19日,上海药监局发布创新医疗器械审评审批问题答疑,对常见的5个关于创新医疗器械问题进行解答。如果你有创新医疗器械注册申报需求,那一定要看。
1、我国对创新医疗器械有无绿色通道?
答:创新医疗器械在高端医疗器械研发中是非常重要的一类产品。国家药监局《创新医疗器械特别审查程序》、上海药监局《上海市第二类创新医疗器械特别审查程序》为创新医疗器械建立绿色通道。
2、创新医疗器械绿色通道有哪些政策优势?
答:第三类创新医疗器械有专人沟通、提供指导,并享有“四优先”:即优先检验、优先体系核查、优先技术审评、优先行政审批。
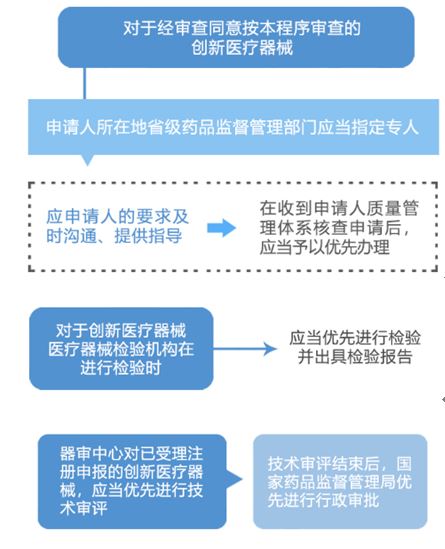
第二类创新医疗器械“四优先”:优先受理、优先审评、优先体系核查、优先审批。
3、哪些产品可以申请创新医疗器械?
答:主要具备三大前提:核心技术发明专利权、国内首创、产品基本定型。
4、关于创新医疗器械特别审查程序中有关专利方面的要求向哪个部门提出检索?
答:国家知识产权局专利检索咨询中心是国家知识产权局直属单位,申请人可向专利检索咨询中心提出检索申请。
5、进入创新特别审查程序医疗器械,按照创新程序申报注册是否有时限要求?
答:审查结果告知后5年内,未申报注册的创新医疗器械,不再按照本程序实施审查。

站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。
ONE-STOP SERVICE
免费赠送3万家医疗器械企业名录