
发布时间:2026-02-03
本指导原则旨在指导注册申请人对遥测监护系统注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的审评提供参考。
本指导原则是对用于遥测监护系统产品的注册申报资料的一般要求,注册申请人需依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对注册申请人和技术审评人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,需在遵循相关法规和强制性标准的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
一、适用范围
本指导原则适用于遥测监护系统的产品注册。按现行《医疗器械分类目录》,该类产品分类编码为07-08-01,管理类别为Ⅱ类。
本指导原则适用的遥测监护系统用于对流动的患者进行生命体征的测量、监护。一般有心电(ECG(不含ST、ARR、QT))、血氧(SpO2)、血压(NIBP)、呼吸(RESP)、体温(TEMP),可在床旁使用或佩戴在病人身上使用。其他具有遥测监护功能的系统或软件可参照本指导原则的适用部分。
二、注册审查要点
(一)监管信息
明确申请表中产品名称、管理类别、分类编码、型号规格、产品组成等信息。
1.产品名称
产品的命名应符合《医疗器械分类目录》、《医疗器械通用名称命名规则》、《医疗器械通用名称命名指导原则》、《医用诊察和监护器械通用名称命名指导原则》和相关法规、规范性文件的要求。产品名称应包括核心词和特征词。例如:“遥测监护系统”或“心电遥测系统”等。
2.分类编码
依据《医疗器械分类目录》,申报产品分类编码为07-08-01。
3.注册单元划分
注册单元划分应符合《医疗器械注册单元划分指导原则》的要求。若申报产品存在多个型号规格或配置,建议依据产品适用范围、技术原理、结构组成、性能指标等关键要素进行注册单元划分。
结构差异较大的,如模块式和预置式,应划分为不同的注册单元。
(二)综述资料
1.概述
描述申报产品的通用名称及其确定依据,描述产品的管理类别、分类编码。
遥测监护系统为Ⅱ类产品,分类编码为07-08-01。
如适用,描述有关申报产品的背景信息概述或特别细节,如:申报产品的历史概述、历次提交的信息,与其他经批准上市产品的关系等。
2. 产品描述
遥测监护系统通常由遥测发射盒主机、外接模块(接收箱/接收盒)以及附件(如心电导联线、血压袖带、血氧探头等)组成,可以选配中央充电站。发射盒负责采集患者的生理参数,然后通过无线网络(可以是通用无线网络,如WIFI,蜂窝通信网络,蓝牙等,专用无线网络如生物医学遥测频率、WMTS等)发送到中央站,中央站进行显示、分析、报警、存储、回顾、打印。发射盒可以自带显示器。
2.1 器械及操作原理描述
2.1.1工作原理
遥测监护系统一般包含生理参数监测、数据处理分析和数据传输通讯功能。
遥测发射盒通常佩戴在病人身上,一般采集心电(ECG),呼吸(RESP),血氧(SpO2),血压(NIBP)、体温(TEMP)等生理参数信息。
遥测发射盒获取的生理参数信息经过预处理后,通过无线网络发送到外接模块(接收箱/接收盒)然后传输到中央站,进行显示、存储、算法处理与报警。
遥测发射盒以及外接模块(接收箱/接收盒)可以在本地做部分算法处理,可以通过显示屏显示生理参数值或波形,并提供部分报警功能。患者可以通过遥测发射盒的护士呼叫功能来向中央站端的医护人员寻求帮助。遥测发射盒可以借助无线网络实现定位功能,支持医护人员快速找到发射盒。
无线网络可以是通用或者专用网络,通用的无线接收网络可以作为遥测监护系统的一部分,也可以独立于遥测监护系统以外,和遥测监护系统配合实现功能。
遥测监护系统的专用无线接收网络通常是厂家自行设计的基于生物医学遥测频段、WMTS频段的定制网络设备(例如天线阵加接收箱实现无线信号接收,或者自行设计工作在生物医学遥测频段、WMTS频段的AP),也可能和第三方无线设备厂商的定制设备绑定,共同保障无线网络服务质量。
综述资料中需描述产品的主要工作原理,如生理信号采集/处理/分析等原理、组网方式和网络通信相关内容。
2.2.2 结构组成
结构组成中需提供产品整体描述资料,产品整体结构示意图、系统框图、实物图及必要的文字解释。需提供产品布置图(工程图示和真实照片等)物理拓扑图等,描述临床场景中遥测监护系统的实际布置情况,图中需要标识产品结构组成的主要部件及其他必要的文字解释。
遥测监护系统可以自带无线网络,如下图所示(图1)。
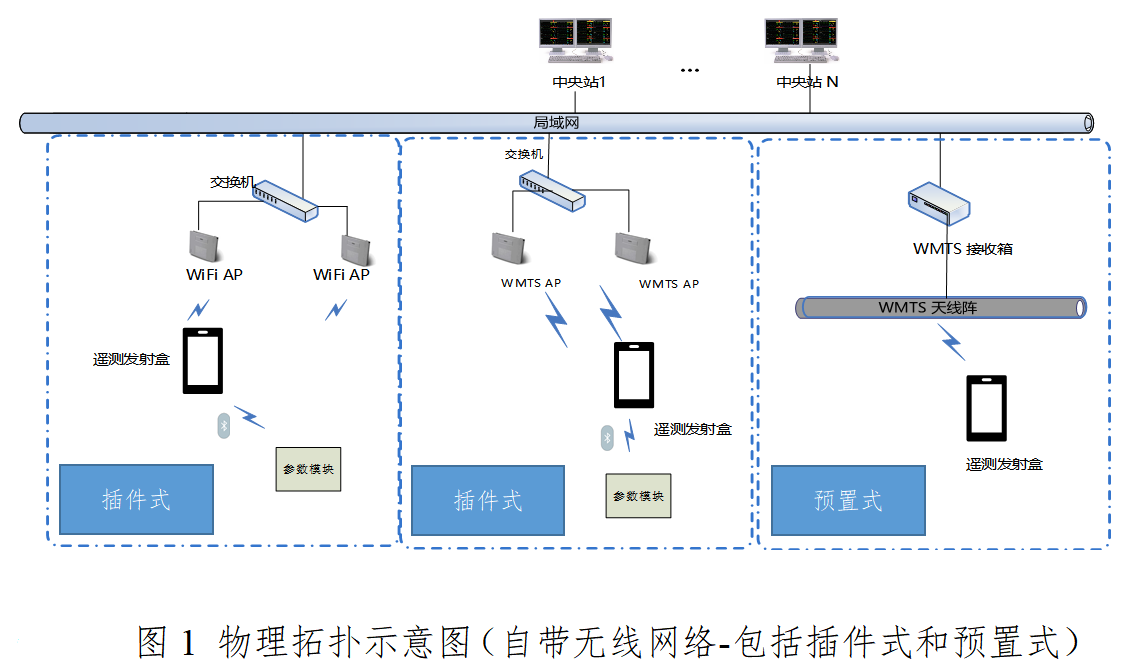
该示例中,遥测发射盒通过WIFIAP、WMTS天线阵或WMTS AP以无线的方式连接到中央站。中央站将获取的数据进行存储,运算,显示和报警。
遥测监护系统也可以和满足技术要求的无线网络共同工作,如下图所示(图2)。
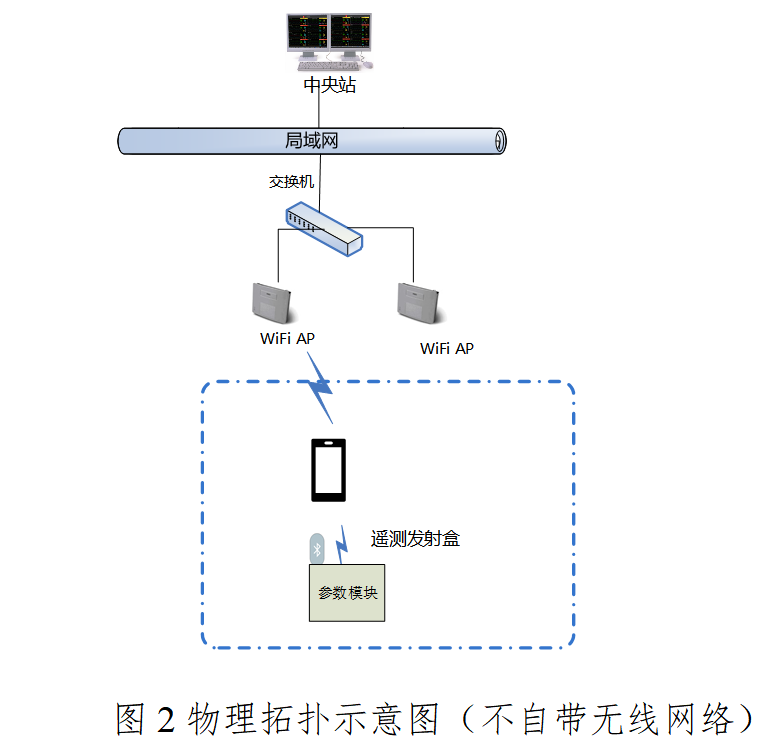
2.2 型号规格
需明确申报产品的型号规格及发布版本。产品型号规格及其划分,如同一个注册单元包含多个型号规格,需提供产品型号规格区分列表或配置表。
3.包装描述
申报产品需要描述注册单元内所有产品组成的包装情况,说明包装清单和包装方式,提供包装图示。
4. 研发历程、与同类和/或前代产品的参考和比较
阐述申请注册产品的研发背景和目的。如有参考的同类产品或前代产品,应当提供同类产品或前代产品的信息,并说明选择其作为研发参考的原因。
若存在可以参考的同类产品/前代产品,建议列表比较说明申报产品与同类产品/前代产品在工作原理、结构组成、制造材料、性能指标、作用方式、适用范围等方面的异同,并重点说明申报产品的新功能、新应用、新特征。
5. 适用范围和禁忌证
5.1适用范围
明确产品使用场景、预期用途、适用人群等。例如,用于对流动的患者进行生命体征的测量、监护。一般有心电(ECG)(不含ST、ARR、QT),呼吸(RESP),血氧(SpO2),血压(NIBP)、体温(TEMP)。可在床旁使用或佩戴在病人身上使用。
5.2预期使用环境
详述产品使用环境条件及储存环境条件,包括:
3.2.1提供产品的储存运输、使用环境要求(温度范围、相对湿度范围、气压范围等)。
3.2.2说明产品可以安全、有效地使用的环境、场景和范围(例如:医院、救护车、院内及院间转运等)。
3.1适用人群
关于适用人群,建议说明:目标患者人群信息,患者选择标准。
5.3 禁忌证
明确产品禁忌证,说明不适用的疾病、临床情况或特定人群(如儿童、老年人、孕妇及哺乳期妇女、肝肾功能不全者),认为不推荐使用该产品,应当明确说明。
6. 不良事件情况
注册申请人应关注并收集同类产品以及申报产品注册周期内的不良事件历史记录,可通过各国监管机构发布的不良事件资料库中查询相应不良事件数据。可以选择产品名称为方向开展医疗器械不良事件查询,通过在已选择的数据库的检索页面输入预期要进行查询的医疗器械产品名称,通过限制检索时间进行相关产品不良事件信息收集。
可以检索公开发布的不良事件信息如下:
(1)国家药品不良反应监测中心发布的“医疗器械不良事件信息通报”及“医疗器械警戒快讯”。
(2)美国不良事件查询数据库MAUDE、召回查询数据库Recall及按年份查询警告信(warning letter)。
(3)英国医疗器械警报(MHRA)。
(4)加拿大召回与警戒(Search recalls and safety alerts)。
(5)澳大利亚TGA不良事件(Database of Adverse Event Notifications - medical devices)、召回(System for Australian Recall Actions)及警戒(All alerts)。
(6)日本PMDA。
(7)德国BfArM。
7. 其他需要说明的内容
如适用,明确与申报产品联合使用实现预期用途的其他产品的详细信息。
提供预期配套使用的其他医疗器械信息(如附件、第三方设备等),说明系统各组合医疗器械间存在的物理、电气等连接方式。说明器械类型、制造商、型号规格、关键技术参数等。对于已获得批准的部件或配合使用的附件,申请人应当提供注册证编号和国家药监局官方网站公布的注册证信息。
(三)非临床资料
1.产品风险管理资料
依据GB/T 42062《医疗器械风险管理对医疗器械的应用》,提供产品风险管理报告。
申请人需重点说明:申报产品的研制阶段已对有关可能的危险及产生的风险进行了估计和评价,针对性地实施了降低风险的技术和管理方面的措施。产品性能测试对上述措施的有效性进行了验证,达到了通用和专用标准的要求。申请人对所有剩余风险进行了评价,全部达到可接受的水平。产品风险分析资料需为申请人关于产品安全性的承诺提供支持。
考虑到产品预期使用的地点(包括但不限于具有健康护理能力的机构或单位等)和环境条件的相关风险〔包括但不限于热能(温度)、绝对湿度和相对湿度、海拔、压力、移动、振动、电磁环境、辐射环境等〕,申请人应在风险分析和管理过程中估计、评价并控制环境因素可能引起的相关风险,同时制造商应说明提出风险控制措施的验证确认资料(含客观证据),验证和确认产品在预期使用环境中的安全性、临床功能和性能。
对于遥测监测产品应特别考虑网络传输带来的风险。如模块与遥测发射盒之间、遥测发射盒与接收盒之间、接收盒与中央站之间的无线通讯,可参考《医疗器械网络安全注册审查指导原则》二十二项医疗器械网络安全能力的进行风险分析,不适用的项目需说明理由。
其他需要考虑的风险:
需要考虑设备移动时网络通讯问题,需说明移动的范围,并提供移动使用时针对相关网络风险采取的控制措施和相关风险分析的资料。
遥测监护系统各部件/模块之间采用了无线通讯技术,应说明不同情况下保证无线通讯质量的措施,保证无线通讯安全措施;与其他无线通讯设备的共存问题,提供相关风险分析资料。
对于网络异常,需提供相应的风险分析资料。遥测监护系统需根据风险等级和危险情况提供识别能力,必要时提供相应的警示或提示。
风险管理报告一般包括以下内容:
1.1申报产品的风险管理组织。
1.2申报产品的组成。
1.3申报产品符合的安全标准。
1.4申报产品的预期用途,与安全性有关的特征的判定。
1.5对申报产品的可能危险作出判定(见附件1)。
1.6对所判定的危险采取的降低风险的控制措施。
1.7对采取控制措施后的剩余风险进行估计和评价。
2.医疗器械安全和性能基本原则清单
说明产品符合《医疗器械安全和性能基本原则清单》各项适用要求所采用的方法,以及证明其符合性的文件。对于《医疗器械安全和性能基本原则清单》中不适用的各项要求,应当说明理由。申请人应着重明确下述项目的适用性,说明遥测监护产品符合适用要求所采用的方法,提供证明其符合性的文件:
2.1 A5环境和使用条件,例如,A5.1、A5.2、A5.4、A5.5、A5.6、A5.7、A5.8等项;
2.2 A6对电气、机械和热风险的防护,例如,A6.1、A6.4、A6.5等项;
2.3 A7有源医疗器械及与其连接的医疗器械,例如,A7.1、A7.5、A7.6、A7.7等项;
2.4 A8含有软件的医疗器械以及独立软件;
2.5 A9具有诊断或测量功能的医疗器械;
对于包含在产品注册申报资料中的文件,应当说明其在申报资料中的具体位置;对于未包含在产品注册申报资料中的文件,应当注明该证据文件名称及其在质量管理体系文件中的编号备查。
3. 产品技术要求和产品检验报告
3.1 产品适用的相关标准
列表说明申报产品符合的国家标准和行业标准,可以参考下表示例。
表1遥测监护系统相关适用标准
|
标准编号 |
标准名称 |
|
|
医用电气设备 第1部分:基本安全和基本性能的通用要求 |
|
YY 9706.102 |
医用电气设备 第1-2部分:基本安全和基本性能的通用要求 并列标准:电磁兼容要求和试验 |
|
YY 9706.108 |
医用电气设备 第1-8部分:基本安全和基本性能的通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南 |
|
GB 9706.227(如适用) |
医用电气设备第2-27部分:心电监护设备安全专用要求 |
|
YY9706.230(如适用) |
医用电气设备第2-30部分:自动循环无创血压监护设备的安全和基本性能专用要求 |
|
YY 9706.261(如适用) |
医用电气设备 第2-61部分:脉搏血氧设备的基本安全和基本性能专用要求 |
|
YY/T 0196(如适用) |
一次性使用心电电极 |
|
YY0828(如适用) |
心电监护仪电缆和导联线 |
|
YY9706.249(如适用) |
医用电气设备 第2-49部分:多参数患者监护仪的基本安全和基本性能专用要求 |
|
YY 9706.256(如适用) |
医用电气设备 第2-56部分:用于体温测量的临床体温计的基本安全和基本性能专用要求 |
|
YY9706.111(如适用) |
医用电气设备 第1-11部分:基本安全和基本性能的通用要求 并列标准:在家庭护理环境中使用的医用电气系统的要求 |
|
YY 9706.112(如适用) |
医用电气设备 第1-12部分:基本安全和基本性能的通用要求 并列标准:预期在紧急医疗服务环境中使用的医用电气设备和医用电气系统的要求 |
3.2 产品技术要求
依据《医疗器械产品技术要求编写指导原则》进行编制。若适用,可以参考本指导原则附件2的模板示例。
3.2.1产品型号/规格及其划分的说明
应列明产品的型号、规格。对同一注册单元中存在多种型号、规格的产品,应明确不同型号、规格的划分说明。
遥测监护系统通常包含软件组件,应明确软件的名称、型号规格(若适用)、发布版本、完整版本命名规则,软件模块(含医用中间件)若有单独的版本、版本命名规则均需说明。
产品技术要求应在“1. 产品型号/规格及其划分说明”中明确所有组网方式(含接入方式和接口要求)对于网络通讯要求,建议明确通讯模块类型(WMTS、wifi、蓝牙、3G/4G/5G等)、通讯协议、网络环境要求(如传输速率等)。
3.2.2性能指标
产品的主要性能指标,包括心电、无创血压、脉搏血氧饱和度、呼吸、体温等生理参数的监护范围、精度等要求。
若遥测监护系统中含有一次性使用心电电极、血氧传感器、血压袖套等附件,应制定相应要求。应符合相应的产品标准和注册审查指导原则的要求,如YY/T 0196、YY 0828等。若配合已获批的附件使用,则应在综述资料的联合使用资料中明确该配合使用产品的注册证信息。
软件功能应符合《医疗器械软件注册审查指导原则》(2022修订版)的要求,明确软件的功能(核心功能(含安全功能)纲要)、使用限制、接口、访问控制。
电气安全应符合GB 9706.1、YY 9706.108中规定的要求,或还应符合专用标准GB9706.227、YY 9706.230、YY 9706.261、YY9706.249、YY 9706.256中电气安全的要求。
电磁兼容应符合YY 9706.102的要求,或还应符合专用标准GB 9706.227、YY 9706.230、YY 9706.261、YY9706.249、YY 9706.256中电磁兼容的要求。
如适用,需符合YY9706.111、YY9706.112的要求。
产品性能指标除了包括医疗器械自身性能指标外,还应包含端到端允许的最大延时(如报警、参数显示时间)要求。
3.3 产品检验报告
申请人可提交以下任一形式的检验报告:
申请人出具的自检报告。
委托有资质的医疗器械检验机构出具的检验报告。
检验报告需要注明产品型号规格或配置,样品描述应与产品技术要求的部件名称和型号等信息保持一致。
产品检验报告提供软件版本界面照片或列明软件版本信息,有用户界面的软件体现软件发布版本、软件完整版本,无用户界面的软件体现软件完整版本。说明书注明软件发布版本。
3.3.1同一注册单元的典型检验产品
按照注册单元进行产品检验,检验结果需要覆盖注册单元内所有产品型号规格或配置。典型检验产品需要考虑结构组成、性能指标、预期用途等,一般选取功能最齐全、结构最复杂、风险最高的产品型号规格或配置,并提供检验典型性说明。
3.3.2产品性能检验
配套附件:若申报产品可以适配不同型号规格的附件,则产品检验需要考虑遥测监护系统配套典型附件的所有组合情况,并分析是否需要全部进行检验。说明检验用配套附件的典型性,以及某些组合是否仅进行了差异项目检验。
3.3.3产品EMC检验
提供EMC检验中产品运行模式的选取依据,并建议考虑产品报警功能。抗扰度试验中,产品基本性能相关的功能均应考虑对患者产生最不利影响的试验方式。辐射发射试验中,产品宜在最大骚扰状态下运行。
3.3.4关于检验情况的说明
提供检验情况说明和检验报告清单,描述检验报告对应的产品型号规格/配置和检验类型(产品性能和安规检验、EMC检验等)。
4. 研究资料
4.1 化学和物理性能研究
(1)提供产品性能研究资料,以及产品技术要求的编制说明,列表说明产品性能指标条款,逐项解释条款来源和制定依据。说明适用的标准或方法,解释引用或采用的理由。关于适用标准中的不适用条款,提供必要的说明。
(2)联合使用
如申报产品预期与其他医疗器械、药品、非医疗器械产品联合使用实现同一预期用途,应当提供证明联合使用安全有效的研究资料,包括互联基本信息(连接类型、接口、协议、最低性能)、联合使用风险及控制措施、联合使用上的限制,兼容性研究等。如适用,提供配套使用的典型附件或第三方设备的兼容性测试资料(如与中央站、其他监护设备联用)、器械联用的集成测试报告等支持性资料。
4.2辐射安全研究
使用无线传输技术的遥测监护系统,使用过程中其电磁辐射暴露可能会对健康产生影响。针对这部分产品提供相关研究资料或说明(考虑无线技术的使用场所和方式,射频辐射功率,频率范围,通讯距离等)。
4.3 数据传输质量和安全专题研究
4.3.1 数据传输质量研究资料
根据临床使用场景、临床使用需求结合产品特性开展数据传输质量研究。研究报告需明确:1)数据传输模块的基本参数(如数据传输方式、频带、通信距离、传输速率、时延等),提供相应测试报告或证书;2)为满足临床需求须达到的数据传输质量要求,说明保证通讯质量的措施,保证通讯安全的措施;3)与其他通讯设备的共存问题,针对相应措施进行测试和验证,提供相应测试验证资料。
对于网络异常,遥测监护系统需根据风险等级和危害情况提供识别能力,必要时提供相应的警示或提示。提供针对网络异常进行相关测试验证的资料。
在数据传输过程中,为保证数据的完整性、可用性,需综合考虑通讯模块、网络环境、传输故障等对数据传输质量的影响,数据传输质量研究报告中应对数据传输的完整性和可用性进行测试和验证。依托于网络通讯传输的,明确申报产品对网络性能的要求,如满足QoS质量评估要求。
通讯模块在保证数据传输顺序性的条件下,需考虑延时、丢包率等要求,在数据(重要数据,如危及生命安全)出错的情况下需具有对应的解决方案,宜具备一定的自愈能力。
4.3.2数据安全研究资料
遥测监护系统,需要考虑数据传输、数据存储、数据使用等数据安全方面的问题,应综合考虑以下有关于数据安全的应对措施,提供数据安全研究报告,验证测试资料可作为研究报告的附件。
4.3.2.1隐私保护
结合申报产品情况明确数据访问的授权策略,包括数据加密、控制访问和查看权限。
4.3.2.2数据完整性
提供数据完整性和保护数据免受未经授权的修改或删除的措施,如数据销毁措施、数据生命周期、对用户访问有日志记录等。
4.3.2.3 数据的语义一致性
从数据被采集到被呈现的过程中,应确保生理参数数据的语义在遥测监护系统、网络设备、中央站等各环节中始终保持一致。
4.3.2.4 数据来源的可追溯性
对于中央站所接收到的每一个生理参数数据,遥测监护系统应在数据流中提供相关信息,确保每一个传输环节都可以进行溯源。
4.3.2.5 数据隐私
应遵守国家隐私保护相关法律法规,说明申报产品符合的相关法律法规要求。
4.3.2.6 加密
加密是保护数据隐私的一种手段,应说明加密措施,以及加密措施的使用情况。
4.3.2.7 攻击威胁
应提交对数据纰漏、数据丢失、账户劫持、密码窃取等威胁的解决措施,及相应验证测试资料。
4.3.2.8 内部安全
公司内部对数据安全的威胁需有应对措施。如技术措施、安全培训、制度管理等。提供相应资料。
4.3 软件研究
遥测监护产品的软件一般属于软件组件,一般不宜单独注册。应按照《医疗器械软件注册审查指导原则》,“严重”安全性级别提供软件研究资料。
如包含人工智能算法,参照《人工智能医疗器械注册审查指导原则》提供相应的研究资料。
应参考说明书列明软件核心功能的相关信息,所用核心算法可以参考下表示例。必要时,可以提供专题研究资料,针对某个核心算法进行详述。
表3 核心算法示例
|
算法名称 |
类型 |
预期用途 |
临床功能 |
|
心电算法 |
成熟 |
对心电进行监测,实时监测并进行处理分析 |
功能A… |
|
无创血压算法 |
成熟 |
基于听诊法对无创血压进行监测,实时监测并进行处理分析 |
功能B… |
|
血氧算法 |
成熟 |
基于红外光对脉搏波进行测量血氧,实时监测并进行处理分析 |
功能C… |
|
… |
… |
… |
… |
4.4 网络安全研究
应当按照《医疗器械网络安全注册审查指导原则(2022年修订版)》的要求,提供网络安全相关研究资料。
4.5 生物学特性研究
生物学评价根据GB/T 16886.1标准进行。应说明产品所用材料及其与人体接触的性质,生物学评价资料应给出实施或豁免生物学试验的理由和论证,并对现有数据或试验结果进行评价。
遥测监护系统具有多个应用部分,如血压袖带、血氧探头、体温探头等,通常与人体表面皮肤接触,应根据接触性质、接触时间、材料的种类等信息选择合适的评价方式,至少应考虑细胞毒性、致敏反应、皮肤刺激等方面的要求。
4.6清洁、消毒、灭菌研究
应明确主机和附件推荐的清洗和消毒工艺(方法和参数)、工艺的确定依据以及验证的相关研究资料。若附件为已注册或备案的产品,应明确按照附件说明书推荐的方法进行清洗、消毒或灭菌。
4.17 可用性工程
遥测监护系统属于中、低使用风险医疗器械,建议参考《医疗器械可用性工程注册审查指导原则》提交使用错误评估报告,包括基本信息、使用风险级别、核心要素、同类医疗器械上市后使用问题分析、使用风险管理、结论等内容。若前期已开展可用性工程工作,亦可提交可用性工程研究报告,用于替代使用错误评估报告。
5. 稳定性研究
5.1 使用稳定性
应当提供主机的使用期限和附件的使用期限或使用次数。可参照《有源医疗器械使用期限注册技术审查指导原则》提供产品使用稳定性的验证资料。可以对该产品进行使用状态列举,完整分析出临床使用的情况,直接进行产品的老化试验研究;也可以将产品分解为不同子部件(如主机、附件)进行评价,应详细分析分解关系,在此基础上通过不同的分解方式(如将产品分为关键部件及非关键部件等)确定产品的使用期限。
5.2 运输稳定性
需提交运输稳定性验证资料,证明在规定的运输条件下,运输过程中环境条件(例如:震动、振动、温度和湿度的波动)不会对医疗器械的特性和性能,包括完整性和清洁度,造成不利影响。可以参考GB/T 14710等相关标准进行研究,提供测试资料。
6. 其他资料
依据产品特征,进一步提供其他研究资料。例如:关于综述资料中描述的产品关键技术和重要功能,可以提供专题研究资料,详述其工作原理、实现方式、应用场景、预期用途、临床价值和标准工作流程,以及验证标准、测试规范、测试设备等。
6.1 临床准确度研究
若适用,申请人应提供关于血压、血氧、体温测量临床准确度的研究资料。
6.1.1 血压临床准确度评估
若产品具有无创血压监测功能,应当按《电子血压计(示波法)注册审查指导原则》、GB 9706.230的要求提供血压临床准确度研究资料。
6.1.2脉搏血氧饱和度准确度评估
若产品具有脉搏血氧饱和度监测功能,应当按《脉搏血氧仪注册技术审查指导原则》、YY 9706.261的要求提供脉搏血氧饱和度准确度研究资料。
6.1.3体温临床准确度评估
若产品具有临床体温测量功能(调整模式下运行的临床体温计),应当按《耳腔式医用红外体温计注册审查指导原则》、《医用红外额温计注册审查指导原则》、YY9706.256的相关要求提供体温临床准确度验证资料。
6.2产品电池的研究资料
若适用,建议开展产品电池的评价研究,并提供相关评价报告,可以参照相应指南。
关于电池的持续工作时间,一般需要考虑的主要影响因素包括:运行模式、电池寿命(充放电次数)和充电状态等。若适用,需要说明在特定条件下的电池预计剩余工作时间的估算方法。
6.3光辐射安全(若适用)
产品包含血氧模块,应根据《脉搏血氧仪注册技术审查指导原则》提交光辐射安全研究资料。
6.4免临床评价
该产品列入《免于临床评价医疗器械目录》(以下简称《目录》)。
应参照《列入免于临床评价医疗器械目录产品对比说明技术指导原则》提交申报产品与《目录》所述内容的对比资料及申报产品与《目录》中已获准境内注册医疗器械的对比说明。存在差异的,应提交差异部分对安全有效性影响的分析研究资料。该资料应能证明申报产品与《目录》所述产品的基本等同性,若无法证明,应开展临床评价。
(四)临床评价资料
如需要开展临床评价,参照《医疗器械临床评价技术指导原则》《医疗器械临床试验质量管理规范》《医疗器械临床试验设计指导原则》《接受医疗器械境外临床试验数据技术指导原则》等文件的要求提交相关资料。如连续无创测血压功能。
(五)产品说明书和标签样稿
产品说明书和标签应符合《医疗器械说明书和标签管理规定》、规范性文件及相关标准的规定。说明书还应关注以下内容:
1.产品型号规格、产品配置
产品说明书需要包含申报产品注册单元内所有型号规格/配置。
2.产品适用范围与禁忌证
产品适用范围。需要明确产品预期用途,规定操作人员需要具备的技能、知识和培训要求。
预期使用环境。使用环境要求一般包括温度、湿度、海拔大气压。
产品安装和调试。需要说明使用场景下的产品配置、系统布局、电源类型、服务器配置、通电试验及性能调试等必要内容,提供安装示意图。
适用人群。说明产品的适用人群。
禁忌证。若适用,应提供必要说明。
产品的适用范围、结构组成及性能指标应与产品技术要求内容一致。
3.性能指标和技术参数
提供符合相关标准的产品技术参数,包括产品技术要求规定的性能指标。例如:产品符合YY 9706.102的EMC信息,包括:指南和制造商声明-电磁辐射、指南和制造商声明-电磁抗干扰、EMC测试电缆信息、基本性能信息等。
应说明关于报警限制的调整范围和报警预置的建议。
如果遥测监护系统申报的产品结构组成中未包含信号接收的通讯模块,则需外接网络通讯设备才能进行远程传输。需说明可以连接何种网络通讯设备,如无线路由器的规格要求,带宽要求,路由器的使用环境,路由器和互联网的连接方式等。
网络要求:应提供网络安全说明和使用指导,明确用户访问控制机制、电子接口(含网络接口、电子数据交换接口)及其数据类型和技术特征、网络安全特征配置、数据备份与灾难恢复、运行环境(含硬件配置、外部软件环境、网络环境,若适用)、安全软件兼容性列表(若适用)、外部软件环境与安全软件更新(若适用)、现成软件清单(SBOM,若适用)等要求。
说明书中应明确所有组网方式(含接入方式和接口要求)、对网络性能的最低限要求(例如:产品稳定正常工作所需的最低带宽或最低传输速率,产品稳定正常工作所需通信信号的最低信号强度和最低信号质量,产品允许的最大时延、丢包率等)、产品对各种网络性能劣化和网络性能受限情形的应对功能、允许的最大用户并发数和形式等。产品接口和联合使用医疗器械。建议说明与申报产品联合使用的医疗器械的型号和制造商,规范接口要求,以及联合使用的注意事项。若需要医务人员进行连接,建议详述连接方法。建议说明申报产品连接的医疗器械、连接构成的系统需要符合的相关标准,以及其他必要信息。
4.注意事项、警告以及提示
申请人应提供遥测监护系统和操作相关的必要内容,一般以“危险”“警告”“注意”等形式体现,应关注下述内容:
应规定产品须由经过培训的专业人员操作;
应提示产品在同一时间仅限于一个患者使用;
应说明产品是否具备防除颤应用部分,并声明当除颤器用于患者时应采取的预防措施;
应说明产品是否可以和高频手术设备一起使用;
应规定电磁兼容方面相关的警告及措施;
应明确是否用于磁共振环境。
5.推荐的清洁和消毒方法
说明需要清洁和消毒的产品部件。产品清洁和消毒的要求,需要符合遥测监护系统的临床实际使用情况。
6.使用期限
注明产品使用期限。
7.产品日常维护和质量控制
提供遥测监护系统质量控制的维护周期和质量检验方法,以及相关标准。
(六)质量管理体系文件
确保产品符合质量管理体系的要求。应依据《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》要求提供质量管理体系核查文件。
三、参考文献
[1]国家市场监督管理总局.医疗器械注册与备案管理办法:国家市场监督管理总局令第47号[Z].
[2]原国家食品药品监督管理总局.医疗器械说明书和标签管理规定:国家食品药品监督管理总局令第6号[Z].
[3]国家药品监督管理局.医疗器械注册申报资料要求和批准证明文件格式:国家药监局公告2021年第121号[Z].
[4]国家药品监督管理局.医疗器械产品技术要求编写指导原则:国家药监局通告2022年第8号[Z].
[5]国家药品监督管理局医疗器械审评中心.医疗器械软件注册审查指导原则(2022年修订版):国家药监局器审中心通告2022年第9号[Z].
[6]国家食品药品监督管理局.医疗器械分类目录:国家食品药品监督管理总局公告2017年第104号[Z].
[7]国家食品药品监督管理局.医疗器械通用名称命名规则:国家食品药品监督管理总局令第19号[Z].
[8]国家药品监督管理局医疗器械审评中心.医疗器械网络安全注册审查指导原则(2022年修订版):国家药监局器审中心通告2022年第7号[Z].
[9]国家药品监督管理局医疗器械审评中心. 远程监测系统注册审查指导原则(2024年修订版):国家药监局器审中心通告2024年第5号[Z]
[10]国家食品药品监督管理总局.关于发布移动医疗器械注册技术审查指导原则的通告:国家食品药品监督管理总局2017年第222号[Z].
[11]GB/T 42062-2022,医疗器械风险管理对医疗器械的应用[S].
[12]GB 9706.1-2020,医用电气设备第1部分:基本安全和基本性能的通用要求[S].
[13]YY 9706.102-2021,医用电气设备第1-2部分:基本安全和基本性能的通用要求并列标准:电磁兼容要求和试验[S].
[14]YY 9706.108-2021,医用电气设备第1-8部分:基本安全和基本性能的通用要求并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南[S].
[15]YY 9706.111-2021,医用电气设备 第1-11部分:基本安全和基本性能的通用要求并列标准:在家庭护理环境中使用的医用电气系统的要求[S].
[16]YY 9706.112-2021,医用电气设备第1-12部分:基本安全和基本性能的通用要求并列标准:预期在紧急医疗服务环境中使用的医用电气设备和医用电气系统的要求[S].
[17]GB 9706.227-2021,医用电气设备第2-27部分:心电监护设备安全专用要求[S].
[18]GB 9706.230-2023,医用电气设备第2-30部分:自动循环无创血压监护设备的安全和基本性能专用要求[S].
[19]YY 9706.261-2023,医用电气设备 第2-61部分 :脉搏血氧设备的基本安全和基本性能专用要求[S].
[20]YY9706.249-2023,医用电气设备 第2-49部分:多参数患者监护仪的基本安全和基本性能专用要求[S].
[21]YY 9706.256-2023,医用电气设备 第2-56部分:用于体温测量的临床体温计的基本安全和基本性能专用要求[S].
[22]YY/T 0196-2005 ,一次性使用心电电极[S].
[23]YY 0828-2011,心电监护仪电缆和导联线[S].
[24]GB 21288-2022, 移动通信终端电磁辐射暴露限值[S].
[25]YD/T 3935.3-2021, 移动通信终端设备电磁照射符合性标准 第3部分:可穿戴设备[S].
[26]YD/T 1644.2-2011, 手持和身体佩戴使用的无线通信设备对人体的电磁照射人体模型、仪器和规程第 2 部分:靠近身体使用的无线通信设备的比吸收率(SAR)评估规程(频率范围 30MHz~6GHz)[S].
[27]YD/T 2828—2015, 多发射器终端比吸收率(SAR)评估要求[S].
附录1:
风险管理资料
危险、可预见的事件序列、危险情况和可能发生的伤害之间的关系(参考)
|
危险分类 |
危险 |
可预见的事件序列 |
危险情况 |
伤害 |
|
能量危险 |
电能 |
应用部分电路参数设计不合理 |
漏电流过大 |
电流泄漏会导致心室纤颤 |
|
遥测监护系统的内部短路,会导致电池电流过大 |
电池损坏,设备无法使用 |
短暂的延误治疗 |
||
|
能量危险 |
电能(磁场) |
设备不满足电磁骚扰强度 |
设备受电磁干扰,出现黑屏 |
短暂的延误治疗 |
|
能量危险 |
热能 |
在高温环境下长时间运行 |
设备外壳温度过高,屏幕过热 |
接触过热设备,皮肤灼伤 |
|
能量危险 |
机械能 |
设备意外的跌落 |
设备损坏,部分功能丧失 |
短暂的延误治疗 |
|
防水设计不合理,设备进液 |
电路短路,部分功能丧失 |
短暂的延误治疗 |
||
|
能量危险 |
势能 |
集中式充电器安装在导轨上时,悬挂力不足 |
集中式充电器从导轨上掉落 |
砸伤人员 |
|
生物和化学危险 |
生物因子 |
重复使用一次性配件 |
附件感染细菌 |
皮肤过敏、感染 |
|
与人体接触的材料不符合生物相容性要求 |
附件材料存在细胞组织毒性 |
皮肤过敏、感染 |
||
|
生物和化学危险 |
化学因子 |
一次性电池过度放电 |
电池漏液,设备部分功能丧失 |
短暂的延误治疗 |
|
医院护士在给病人贴放电极片前会用不合适的药剂清洗贴电极片处的皮肤,心电电极片与残留的药剂(如松节油)在人体表面产生化学反应 |
化学反应产生热量 |
灼伤皮肤 |
||
|
性能有关的危险 |
功能性 |
导联脱落,无法检测到患者的生理参数(如ECG)信号 |
没有导联脱落提示 |
短暂的延误治疗 |
|
医护人员设置不正确,报警功能被禁用 |
设备报警无法被有效识别 |
病人生命体征出现异常,延误治疗 |
||
|
接口无防呆设计 |
附件插混,测量失败 |
短暂的延误治疗 |
||
|
血压由于阀门或气路阻塞,气路无法放气,导致长时间按压测量位置 |
长时间按压测量位置,测量失败 |
阻碍血液循环,造成瘀伤 |
||
|
因为病人涂有诸如指甲油等染料或者类似物质会影响光的吸收能力,血氧值测量不准确 |
向临床医生报告的信息不正确,导致误诊和/或缺乏适当的治疗 |
病情恶化 严重损伤 |
||
|
性能有关的危险 |
功能性 |
硬件故障导致系统软件异常运行 |
主控系统故障,设备无法正常使用 |
短暂的延误治疗 |
|
受环境影响,设备的性能下降 |
设备部分功能故障,测量异常 |
短暂的延误治疗 |
||
|
性能有关的危险 |
输送 |
多台遥测监护系统并发消息,导致AC处理响应能力下降 |
AC(网络控制器)崩溃导致网络中断 |
短暂的延误治疗 |
|
中央站通过网络获取遥测仪上监测的病人数据,网络信号不好 |
延迟显示病人测量数据 |
短暂的延误治疗 |
||
|
性能有关的危险 |
数据 |
在医院遥测监护系统运行过程中,将医院未经授权的无线设备连接到AP或遥测监护系统,其他设备可能恶意篡改患者的波形、参数、报警、设置、历史数据和信息 |
患者的波形、参数、报警、设置、历史数据和信息可能被更改,向临床医生报告的信息不正确,导致误诊和/或缺乏适当的治疗 |
病情恶化 严重损伤 |
|
连接到AP的无线设备过多,为每个设备分配的带宽太小,无法传输所有数据 |
遥测监护系统和中央站之间传输的数据丢失,向临床医生报告的信息不正确,导致误诊和/或缺乏适当的治疗 |
病情恶化 严重损伤 |
||
|
遥测监护系统和参数模块之间无法建立通信 |
参数模块的蓝牙模块无法正常工作 |
短暂的延误治疗 |
||
|
未授权的人员访问维护数据,进行参数模块校准 |
校准失败,测量不准,向临床医生报告的信息不正确,导致误诊和/或缺乏适当的治疗 |
病情恶化 严重损伤 |
||
|
未授权的人员访问网络,更改网络端口 |
通信数据错误,报警信息无法及时发送 |
短暂的延误治疗 |
||
|
当中央站更改设置时,遥测监护系统离线,无法更新设置,并且中央站显示设置成功 |
中央站与遥测监护系统设置不一致 |
病人状态有变化,但未出现异常 |
||
|
同步功能的准确性降低 |
同频干扰,离线丢失次数 |
短暂的延误治疗 |
附录 2
产品技术要求模板
该模板为产品技术要求的一个推荐性示例。
该模板中所有的要求、数值、条款等具体内容,均为可能的情况举例,切勿视为强制性要求执行,仅供申请人在编制产品技术要求时进行参考。同时应结合申报产品具体情况明确具体要求
医疗器械产品技术要求编号:
遥测监护系统
1.产品型号/规格及其划分说明
1.1.产品型号/规格
……
1.2.产品型号的划分说明(如适用)
……
1.3.软件信息
明确软件名称、软件型号规格、软件发布版本、软件版本命名规则。
1.4.网络通讯模块参数(如有)/接口
通讯模块/接口类型:如网线、串口、wifi、蓝牙、3G/4G/5G等
通讯模块参数(如有):通讯协议(如HL7、ISO/TC 215、ISO/IEEE 11073等)、频带、通信距离、数据传输方式(如有线传输、无线传输、存储设备传输等)
网络要求:带宽、传输速率等
2.性能指标
2.1.安全
应满足GB 9706.1-2020、GB 9706.227-2021、YY 9706.230-2023、YY 9706.249-2023、GB 9706.255-2022、YY 9706.256-2023、YY 9706.261-2023的要求…,产品主要安全特征见附录A。
2.2.电磁兼容性
应满足YY9706.102-2021、GB 9706.227-2021、YY 9706.230-2023、YY 9706.249-2023、GB 9706.255-2022、YY 9706.256-2023、YY 9706.261-2023的要求…
2.3.心电(如适用)
2.3.1.应满足GB 9706.227的要求。
2.3.2.心电输入
支持XX导、XX导ECG导联线作为ECG输入来源。
2.3.3.灵敏度(增益)及误差
…
2.3.4.扫描速度
…
2.3.5.心率测量范围、测量误差、分辨率
…
2.4.脉搏血氧饱和度(如适用)
2.4.1.应满足YY 9706.261的要求。
2.4.2.血氧饱和度测量范围、测量误差和分辨率
…
2.4.3.脉率测量范围、测量误差和分辨率(如适用)
…
2.5.无创血压(如适用)
2.5.1.应满足YY 9706.230的要求。
2.5.2.静态压力测量范围、测量误差和分辨率
…
2.5.3.血压测量范围、测量误差和分辨率
…
2.5.4.脉率测量范围、测量误差和分辨率(如适用)
…
2.6.体温(如适用)
2.6.1.应满足YY 9706.256的要求。
…
2.6.2.测量范围、测量误差和分辨率
…
2.7.网络及接口
2.7.1.数据接口(注:建议说明数据接口符合的标准和通讯协议类型)
如可提供蓝牙接口、WMTS接口、5G接口。
2.7.2.蓝牙接口
通讯协议:Bluetooth Baseband
工作频率:2402 ~ 2480MHz
数据安全:Bluetooth LMP
2.7.3.WMTS接口
通讯协议:私有协议;
工作频率:608–630MHz;
数据安全:私有协议。
2.7.4.5G接口
通讯协议:3GPP标准;
工作频率:如FR1频段(Sub-6 GHz),覆盖410 MHz至7125 MHz;
FR2频段(毫米波),覆盖24.25 GHz至52.6 GHz;
数据安全:DTLS协议。
2.7.5.其他接口
……
2.8.数据传输质量要求
2.8.1.传输要求:通讯模块在保证数据传输顺序性的条件下,要求时延不高于XXX,丢包率不高于XXX。
2.9.电池工作时间(如适用)
全新充满电的电池,在企业声称的工作条件(如环境温度xx℃,连接所有参数模块及参数附件, 蜂鸣器不响,屏幕不亮),向中心站传输数据,工作时间不小于XX h。
2.10.外观与结构
外观应端正,色泽均匀,不应有明显凹凸、裂纹、锋棱毛刺;
文字和标志应清晰、准确、牢固;
各控制部件操作应灵活、可靠,紧固件无松动现象。
2.11.正常工作状态
……
2.12.附件要求
3.检验方法
3.1.安全
按照2.1项对应的方法,进行全面检验,应符合2.1的要求。
3.2.电磁兼容性
按照2.2项对应的方法,进行全面检验,应符合2.2的要求。
3.3.心电试验
……
4.术语(如适用)
4.1.……
4.1.1.……
……
(分页)
附录A产品主要安全特征
1.按防电击类型分类:
2.按防电击的程度分类:
3.按对进液的防护程度分类:
4.按在与空气混合的易燃麻醉气或与氧或氧化亚氮混合的易燃麻醉气情况下使用时的安全程度分类:
5.按运行模式分类:
6.设备的额定电压和频率(包括电池额定电压、额定容量):
7.设备的输入功率:
8.设备是否具有对除颤放电效应防护的应用部分:
9.设备是否具有信号输出或输入部分:
10.永久性安装设备或非永久性安装设备:
11.电气绝缘图:
制造商应在电气绝缘图中标明各绝缘路径。
12.电气绝缘图表格:
制造商应在绝缘图表格中明确各绝缘路径的名称、绝缘类型、基准电压、试验电压、电气间隙和爬电距离。海拔、过压类别、污染等级、材料组别

站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。
ONE-STOP SERVICE
免费赠送3万家医疗器械企业名录