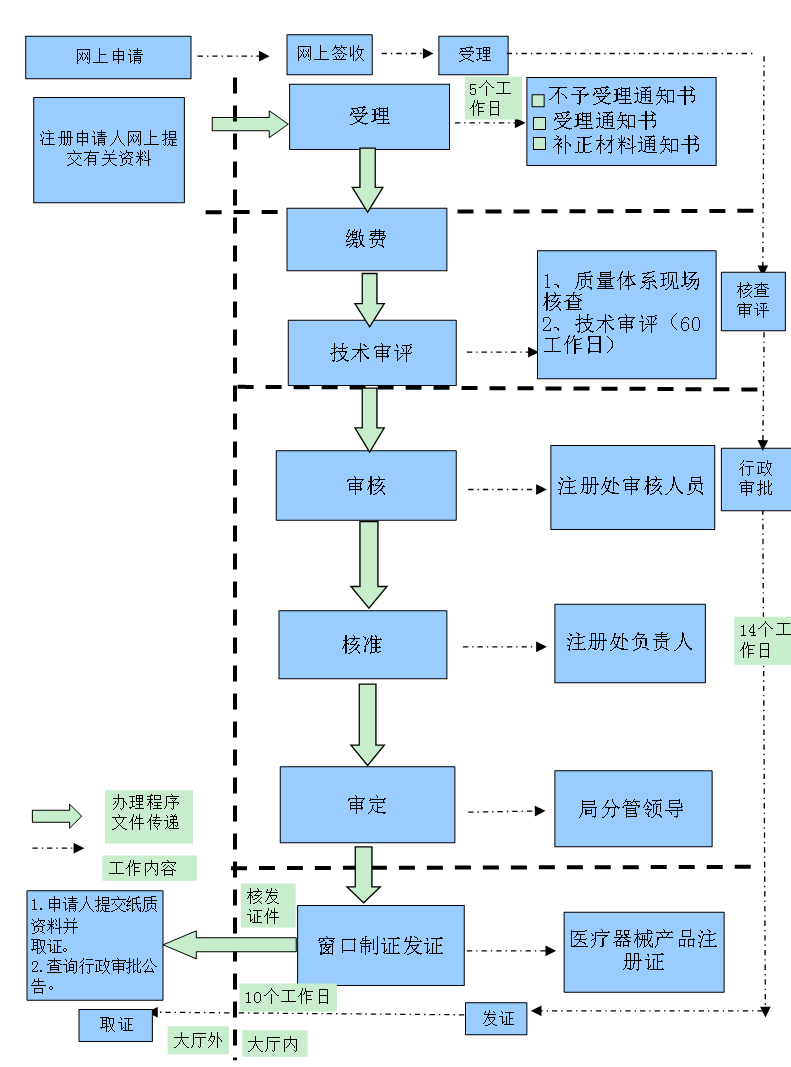
想必大家都知道,医疗器械在上市销售之前,都需要到药监局进行注册备案,因为这样对使用的医疗器械的安全性、有效性进行系统评价,以决定是否同意其销售、使用。它分为境内
医疗器械注册和境外医疗器械注册,境外的医疗器械不管是一类,二类,三类都要到北京国家食品药品监督局办理:境内的一,二类医疗器械在当地的省或市食品药品监督局办理,三类的到国家食品药品监督局办理。医疗器械注册证是指医疗器械产品的合法身份证。下边是小编整理的详细的医疗器械注册申报流程,希望对大家能有所帮助!
注册申报资料准备
受理前咨询
一、受理前咨询范围
受理前咨询全称为医疗器械注册受理前技术问题咨询。
咨询的范围主要是医疗器械注册申报前的相关问题,不包含技术审评过程中的相关问题。
二、受理前咨询申请
每周五下午1:00至4:00,北京市西城区宣武门西大街大成广场行政受理服务大厅。
境内申请人携带:注册申请人出具的涵盖相关委托内容的委托书、个人有效身份证件、医疗器械技术审评中心咨询登记表。
境外申请人携带:境外注册申请人指定境内企业法人作为代理人的委托书、境内代理人出具的涵盖相关委托内容的委托书、个人有效身份证件、医疗器械技术审评中心咨询登记表。
三、受理前咨询流程
先按照《关于启用总局行政受理服务大厅网上预约受理系统的公告》(第192号)的要求进行用户注册。
可在每日7:00至23:00登录预约系统的"器械受理前咨询(一)、(二)、(三)"端口,按照"注意事项"中有关要求进行预约,填写并上传"医疗器械技术审评中心咨询登记表"(最多填写5个咨询问题且咨询问题应符合相应咨询部门的职责范围)。
依照预约时间准时到服务大厅进行咨询。
如未预约或未预约成功,可按相关要求现场取号,领取并填写、提交"医疗器械技术审评中心咨询登记表"(最多填写5个咨询问题且咨询问题应符合相应咨询部门的职责范围),等待中心以电子邮件的方式进行回复。
四、注意
中心会定期发布通告,公布具体咨询工作的安排。行政相对人须按照中心公布的咨询安排,选择相应审评部门预约咨询。
提前10个工作日进行预约!
每个咨询日单个咨询部门可预约15个号。
自2019年7月起,中心在医疗器械注册受理前技术问题咨询工作中增加"电子申报"相关咨询,具体安排请关注中心官网。
医疗器械注册申报流程