
发布时间:2021-02-05
附件:B型超声诊断设备(第二类)产品注册技术审查指导原则.doc
本指导原则旨在指导和规范第二类B型超声诊断设备的技术审评工作,帮助审评人员理解和掌握该类产品原理/机理、结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性作出系统评价。
本指导原则所确定的核心内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围
本指导原则适用于《医疗器械分类目录》中第二类B型超声诊断设备(以下简称B型超声诊断仪),类别代号为6823。
二、技术审查要点
(一) 产品名称的要求
B型超声诊断设备产品的命名应采用《医疗器械分类目录》或国家标准、行业标准中的通用名称,或以产品结构和应用范围为依据命名。B型超声诊断仪是指频率范围在2~7.5 MHz以内,主要采用B型成像方式,用于医学临床诊断的通用设备(依据GB 10152-1997标准)。
依据GB 10152-1997标准,其产品名称应为B型超声诊断设备,但在实际应用中常采用的名称有:B型超声诊断仪、机械扇扫B型超声诊断仪、数字化B型超声诊断仪、线阵扫描B型超声诊断仪、凸阵扫描B型超声诊断仪、相控阵扫描B型超声诊断仪等。建议规范名称为XXX型(系列)+ B型超声诊断仪。若采用数字化波束成形技术的数字化设备,其规范名称为XXX型(系列)+ 数字化B型超声诊断仪。
(二)产品的结构和组成
B型超声诊断仪的结构型式可为便携式、台车式,主要由主机(含软件)、显示器、探头和附件(如图像记录仪、图像存储器、彩色打印机、穿刺架等)组成。探头主要由阵列换能器、传输线、连接器(可以含有控制器)等组成。探头应明示基元数(如64、80、96、128)、频率、阵列长度或曲率半径。产品图示举例:
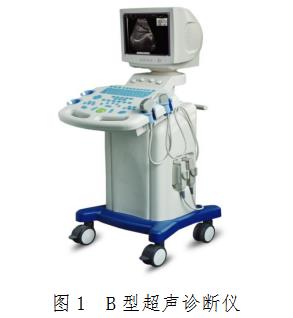

(三) 产品工作原理:
超声波频率在20kHz以上。医学常用的诊断性超声频率范围一般在1~10MHz。超声波波长短,易于集中成一束射线,因此具有很好的直线定向传播特性。超声波在体内传播过程中,各种组织的声学界面产生不同的反射波和透射波,其中一部分可以返回换能器,再由换能器将声信号转换成电信号,并由主机接收放大以声像图形式显示于屏幕上。
B型超声诊断仪主要由探头和主机两部分组成。超声波的发射与接受均由探头来完成。主机供给一定频率、一定激励电压的电讯号作用于探头,探头产生一定频率的超声波。B型超声诊断仪以光点亮度明暗显示体内某一断层界面回声信号的强弱。信号强弱用灰阶表示(通过多阵元探头的多声束连续扫描,可将不同亮度光点组合成平面断层二维图像)。B超诊断仪可获得人体软组织器官的实时二维断层图像,清晰地观察脏器形态、解剖层次及毗邻关系。
超声波能够区分两个相邻界面回声信号最短距离的能力称为分辨力。通常,频率越高,则波长越短,分辨力越高,穿透能力越弱;反之,频率越低,则波长越长,分辨力越低,穿透能力越强。因此检查浅表器官如甲状腺、乳腺等,多采用高频探头,如线阵7.5MHz探头,而对心脏、腹部等深部脏器,则采用低频探头,如凸阵3.5MHz探头,以增加其穿透性。
(四)产品作用机理
因该产品为非治疗类医疗器械,故本指导原则不包含产品作用机理的内容。
(五)产品适用的相关标准
目前与B型超声诊断仪产品相关的常用标准列举如下:
表1 相关产品标准
| GB/T 191-2008 | 《包装储运图示标志》 |
| GB 9706.1-2007 | 《医用电气设备 第1部分:安全通用要求》 |
| GB 9706.9-2008 | 《医用电气设备 医用超声诊断和监护设备专用安全要求》 |
| GB 9706.15-2008 | 医用电气设备 第1-1部分:安全通用要求 并列标准:医用电气系统安全要求 |
| GB 10152-1997 | 《B型超声诊断设备》 |
| GB/T 14710-1993 | 《医用电气设备环境要求及试验方法》 |
| GB/T 16846-2008 | 《医用超声诊断设备声输出公布要求》 |
| YY/T 1142-2003 | 《医用超声诊断和监护设备频率特性的测试方法》 |
| YY/T 1084-2007 | 《医用超声诊断设备声输出功率的测量方法》 |
| YY/T 0108-2008 | 《超声诊断设备M模式试验方法》 |
| YY 0505-2005 | 《医用电气设备 第1-2部分:安全通用要求-并列标准:电磁兼容-要求和试验》 |
| GB/T 16886.1-2001 | 《医疗器械生物学评价 第1部分 评价与试验》 |
| GB/T 16886.5-2003 | 《医疗器械生物学评价 第5部分 体外细胞毒性试验》 |
| GB/T 16886.10-2005 | 《医疗器械生物学评价 第10部分 刺激与迟发性超敏反应试验》 |
上述标准包括了注册产品标准中经常涉及到的标准。有的企业还会根据产品的特点引用一些行业外的标准和一些较为特殊的标准。
产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是在编写注册产品标准时与产品相关的国家、行业标准是否进行了引用,以及引用是否准确。可以通过对注册产品标准中“规范性引用文件”是否引用了相关标准,以及所引用的标准是否适宜来进行审查。此时,应注意标准编号、标准名称是否完整规范,年代号是否有效。
其次对引用标准的采纳情况进行审查。即,所引用的标准中的条款要求,是否在注册产品标准中进行了实质性的条款引用。这种引用通常采用两种方式,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
注意“规范性应用文件”和编制说明的区别,通常不宜直接引用或全面引用的标准不纳入规范性引用文件,而仅仅以参考文件在编制说明中出现。
如有新版强制性国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行......

站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。
ONE-STOP SERVICE
免费赠送3万家医疗器械企业名录