
发布时间:2023-03-09
摘要
临床需求驱动,政策支持促进,内镜渗透率提升空间大。医用内窥镜通过人体自然腔道或微创手术的小切口进入人体,帮助医生进行疾病诊断或协助手术的进行。内窥镜应用于微创诊疗的临床价值明确,临床渗透率在发达国家远超中国。2019年,我国的上、下消化道内镜诊疗开展率仅有日本的19.0%和25.0%,微创外科手术渗透率不及美国的一半。随着我国医疗水平的不断进步以及民众健康意识的增强,内窥镜的渗透率稳步提升。近年来,常规内窥镜已降为二类医疗器械,且免于临床试验,产品注册门槛大大降低。政策的大力支持也将促进行业快速发展。
内窥镜国产化加快,开立、澳华、迈瑞表现突出。2020年,全球医用内窥镜市场规模约203亿美元,中国市场规模约131亿元。奥林巴斯作为内镜市场的领军者, 2019~2022财年间中国区内镜收入的年复合增长率约6%,而国产领军企业的收入增速远超奥林巴斯。软镜市场上,开立、澳华2018~2021年间内镜收入的年复合增长率分别达40.4%、30.7%,开立超过宾得成为当前市占率第三。硬镜市场上,迈瑞超过史赛克成为当前市占率第三。整体来看,2018年,内窥镜的国产化率不足10%,2022年提升至约15%,国产化进度加快。
技术进步、产品创新开启内窥镜发展新篇章。在内窥镜的技术与产品创新上,国产企业紧跟外资步伐。一方面,内镜图像清晰度不断提升,实现4K超高清,探索3D影像应用。另一方面,复合成像技术得到发展,荧光内镜、超声内镜、共聚焦显微内镜等产品不断满足多样化临床需求。此外,一次性内镜在泌尿科、呼吸科表现出较高的应用潜力,免洗消的优势使一次性内镜在某些场景下成为对复用式内镜的重要补充。
01 结合光电算多领域技术,内镜助力微创诊疗时代
医用内窥镜是一个带有光源的管道,通过人体自然腔道或微创手术的小切口进入人体,帮助医生进行疾病诊断或协助手术的进行。目前的医用内窥镜系统由内窥镜镜体、图像处理中心和监视器三大模块组成,是结合了传统光学、现代电子、软件算法、人体工程学、精密机械等多学科知识于一身的精密检测仪器。
步入微创诊疗时代,内窥镜作为最重要的发展方向之一,无论在技术发展、临床需求、政策引导上,都值得市场持续关注。
1.1 发展历程:硬镜至软镜,应用更广泛;光学转电子,图像更清晰
内窥镜有多种分类方式:按产品结构可分为硬镜和软镜;按成像原理可分为光学镜、光纤镜和电子镜;按使用次数可分为复用式内镜和一次性内镜;按临床应用又可分为消化内镜、呼吸内镜、腹腔镜、关节镜等。随着行业的发展,内窥镜种类在不断创新和更迭。

内窥镜广泛应用于临床诊疗,在不同科室的应用和侧重不尽相同:在消化科,消化内镜是进行消化系统肿瘤筛查的金标准;在多个外科科室,腹腔镜等内镜是辅助微创手术的重要医疗器械。

在内窥镜200多年的发展历程中,出现了几次重大技术突破,将内窥镜带入了不同的发展阶段:

第一阶段:光学硬镜、半屈式内镜(1806年起)
1806年,德国医生Philip Bozzini在病人的肛门内插入一根硬管,借助于蜡烛的光亮,观察膀胱和直肠内部病变,这被认为是内窥镜发展史的开端。
1932年,德国人Schindler与Wolf成功研制出一种半屈式内镜,前端部分可在不同水平面弯曲34°。这种内镜由48个透镜组成光学系统,灯泡光亮度强,医生能清晰地观察图像。
1960年,卡尔史托斯公司成功研发冷光源;1965年,卡尔史托斯公司研发推广HOPKINS柱状透镜技术,直至今天,硬性光学镜仍使用这一结构。
第二阶段:光纤内镜(1957年起)
1954年,光导纤维技术被发明,内窥镜实现了一大历史性突破,应用光纤传像的内镜登上舞台。
1964年,奥林巴斯将光纤内镜应用在胃照相机中,实时观察胃内状况。
随着附属装置的不断改进,如手术器械、摄影系统的发展,内镜不但可用于诊断,且可用于手术治疗,这意味着微创手术时代的到来。
第三阶段:CCD电子内镜(1983年起)
1983年,美国Welch Allyn公司成功研制微型图像传感器(charge coupled device, CCD)并应用在内窥镜中,宣告了电子内镜的诞生。随后,日本的富士、奥林巴斯等企业相继宣告电子内镜的成功研制。
从像素数量上看,光纤内镜的分辨率一般为2万像素,而应用CCD的电子镜分辨率一般是光纤内镜的20倍,这使得电子内镜的图像质量、细节信息、清晰程度都有了极大提升,基于内窥镜的诊疗技术开启了新的篇章。
上世纪70~90年代,全球超过半数的半导体在日本生产,全球前10大半导体公司中,日本一度独占6家,这使得日本的内镜企业极具发展优势。
第四阶段:CMOS电子内镜(1995年起)
1995年,几位华人留学生在硅谷创立豪威,这家企业实现了此后CMOS(Complementary Metal Oxide Semiconductor,互补金属氧化物半导体,一种集成电路的设计工艺)技术对图像传感器市场的破局。在当时的工艺条件下,CMOS的成像质量相较CCD稍差,但却可以做到功耗和成本的极大降低。随着索尼、三星等传统半导体巨头的加入和CMOS生产工艺的精进,CMOS图像传感器的性能逐渐提高,在内窥镜中的应用研究也逐渐展开。与CCD相比,CMOS传感器具有成本低、集成度高、耗电量小等优点。
2019年,豪威被中国半导体企业韦尔股份收购。中国半导体行业紧抓CMOS的发展趋势,逐步扩大国产CMOS芯片在各细分市场的应用。CMOS技术的发展与成熟,不仅推动了内窥镜又一次的技术变革,也给了国产内窥镜企业良好的发展机遇。

目前,市场上的软镜主要使用电子镜方案,CMOS摄像头在镜体前端,镜体可弯曲,镜体后端连接图像处理装置;硬镜中电子镜与光学镜两种方案并存,电子硬镜的优势是不像光学镜易损坏、不需手动调焦,而光学硬镜的优势是透镜组传像的保真度高,CMOS安装在镜体后端不受镜体直径限制。
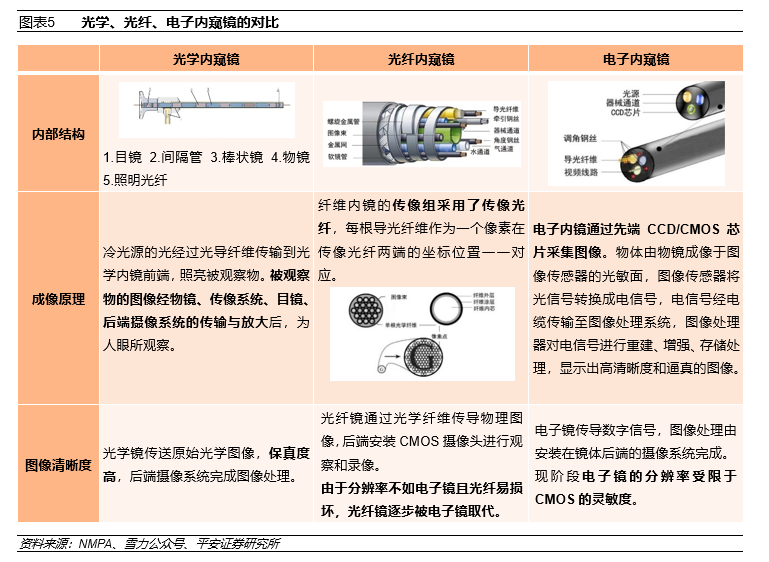
1.2 临床应用:临床价值明确,渗透率亟待提高
内窥镜的临床应用广泛,临床价值明确。软镜中至少65%以上的市场份额属于消化内镜,主要用于消化系统疾病的诊断和治疗,呼吸科、耳鼻喉科、泌尿科等科室也会使用软镜进行相关疾病的诊断与治疗。硬镜的代表产品是腹腔镜,此外还有胸腔镜、关节镜、宫腔镜等;硬镜主要用于微创手术中,在我国,90%的硬镜在普外科、泌尿科、胸外科、妇科、骨科这五个科室使用。
我国内镜渗透率仍待提高。尽管经过多年发展,我国拥有各类内镜的医院数量和掌握内镜诊疗技术的医生数量都有增长,但是对比日本或美国等发达国家,我国内镜的基础建设和诊疗渗透率都有明显差距,未来仍有较大提高空间。
1.2.1 消化内镜筛查可显著降低消化系统癌症死亡率,我国渗透率较低
消化内镜是软镜中市场占比最大的产品品类,主要应用于消化系统疾病诊断和体检项目中,也可以在发现息肉等病变后直接进行镜下切除。
我国消化系统恶性肿瘤高发。以胃癌为例,2020年我国胃癌新发病例47.9万例,死亡病例37.4万例,分别占全球胃癌新发和死亡病例的44.0%和48.6%。对于消化系统恶性肿瘤患者,若能在早期发现,其5年生存率可达到90%以上,而一旦病情进展到中晚期,患者的5年生存率将下降至不到30%。早发现、早诊断、早治疗是降低消化系统癌症死亡率的关键手段,消化内镜和病理切片正是进行早期消化系统癌症筛查的指南标准。
2003~2015年,我国胃癌5年相对生存率,从27.4%提高至35.1%,但仍然明显低于日本的80.1%和韩国的75.4%,其重要原因是,与日韩相比,我国消化内镜的基础建设和诊疗开展量都与之相距悬殊。
2019年,我国开展消化内镜诊疗的各级医院总数为6361家,以二级甲等医院占比最多;而日本在2017年开展消化内镜诊疗的医疗机构达到10.88万家,超过93%在基层的一般诊疗所。日本消化内镜的基础建设水平远远高于我国,这是其提高消化内镜早癌筛查渗透率的基础。

此外,和日本相比,我国人均拥有的消化内镜医师数量和诊疗开展量也相差巨大。每100万人内镜医师数,我国仅有日本的14.7%;每10万人上消化道和下消化道的内镜诊疗量,我国仅有日本的19.0%和25.0%。

在亚洲的胃癌高发国家中,只有日本和韩国开展了全国性的胃癌筛查计划。根据我国2022年颁布的《中国胃癌筛查与早诊早治指南》,胃癌高危、中危和低危人群,建议分别以每年、每2年、每3年的频率进行1次胃镜检查。随着消化内镜技术在我国各级医院的持续渗透和民众对于相关疾病认知度的提升,未来我国消化内镜的基础建设将不断完善,诊疗开展量也将持续增长。
1.2.2 硬镜下的微创手术已获临床认可,整体渗透率仍待提升
微创外科手术,是指通过微小切口完成手术治疗的方式,主要包括腹腔镜、胸腔镜、宫腔镜和关节镜手术。2019年,中国超过90%的微创手术应用于普外科、妇产科、泌尿外科、胸外科和骨科五个科室。这五个科室的手术,除流产手术或患者存在特殊身体状况或特殊病变部位,大部分术式均适用微创手术。

对比开放手术,硬镜下的微创手术具有伤口小、出血少、疼痛轻、恢复快的优势,部分术式在我国较发达地区已发展至较成熟,但不同术式和不同地区的微创手术渗透率还存在差异。
以腹腔镜为例,在普外科其应用术式从良性病变脏器的切除与修复扩展至恶性肿瘤手术。目前在结直肠外科、胃外科、胰腺外科、肝脏外科等多个科室,腹腔镜手术的安全性和可行性都得到了循证医学证据支持。

另根据《中国三级医院胸外科学科临床发展现状的调查研究》,1995年~2015年这20年间,我国胸腔镜微创手术得到了迅速普及,2015年时,我国所有肺癌手术中,73.74%通过胸腔镜微创完成,比例高于美国及欧洲的同期数据。
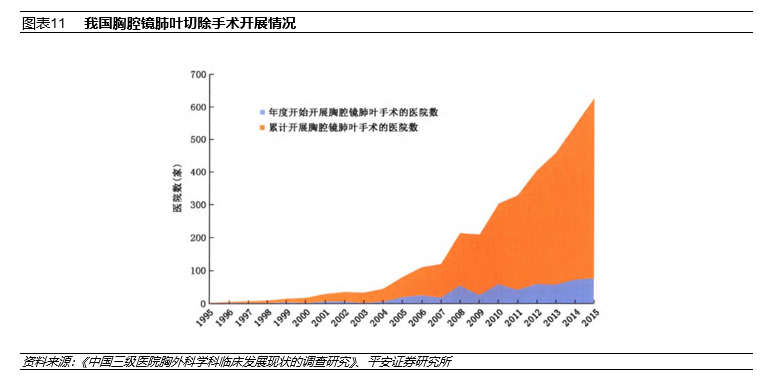
然而,与肺癌相比,胸腔镜下的食管癌微创手术在我国发展相对缓慢,疾病的早诊与早治仍面临较大挑战。并且我国不同地区间胸外科的发展水平存在较大差异。中、西部地区医院胸外科的规模(胸外科医师数)、业务量(年手术量)及新技术开展情况(胸腔镜肺癌、微创食管癌手术比例)都低于东部地区医院。
中国微创外科手术的整体渗透率仍有较大增长空间。根据灼识咨询,自2015到2019年,中国每百万人口接受微创外科手术的数量及其渗透率从4248台及28.5%增长至8514台及38.1%。而美国在2019年,每百万人口接受微创外科手术的数量及其渗透率分别为16877台及80.1%。随着患者负担能力的提高,掌握微创外科手术的医生数量增加,预计于2024年,中国每百万人口接受微创外科手术的数量及其渗透率将增长至18242台及49.0%。

1.3 政策引导:常规产品降级免临床,多类产品国产化率达到50%以上
近年来,国家多部门颁布了多项内窥镜相关的政策文件,这些政策从发展战略、产品注册、临床试验和采购选择上,为国产企业的快速发展奠定了基础。
内窥镜的发展战略:强调支持发展高清电子内窥镜、复合内窥镜成像系统,如共聚焦内窥镜、超声内窥镜。
内窥镜的注册:常规内窥镜产品由三类降级为二类管理,明显缩短了产品的注册周期。根据2020年国家药监局的最新规定,光学内窥镜、电子内窥镜、妇科内窥镜3类内窥镜均被分类为第二类医疗器械,由地方药监局审批上市;而电凝切割内窥镜、胶囊内窥镜系统、超声电子内窥镜、复合内窥镜、眼科内窥镜及附件被分类为第三类医疗器械,需要国家药监局审批上市。
内窥镜的临床试验:根据2018年~2021年间NMPA发布和修订的《免于进行临床试验医疗器械目录》,目前常规内窥镜产品均可免于临床试验,这一规定大大降低了常规内窥镜产品的注册门槛。同时,根据国家器审中心的解释,创新产品如一次性使用电子内窥镜、三维内窥镜和胶囊式内窥镜,目前不属于免于进行临床试验目录的产品。
内窥镜的政府采购:2021年,国家财政部及工信部颁布文件,要求内窥镜摄像系统(胆道镜、椎间孔镜、3D腹腔镜)全部采购国产产品,胸腔镜系统、宫腔镜检查镜、关节镜的国产产品采购比例至少达到75%、50%、50%,采购进口产品需进行专家论证。该文件表明了政府对于国产内窥镜企业大力支持的态度,在国产产品质量达到医院要求的前提下,国产产品进院和放量的速度将加快。
内镜临床应用:将内镜诊疗技术实施分级管理,明确各类内窥镜辅助的四类和三类手术类别,这一规定有利于内镜下的手术在各级医疗机构规范开展。

02
由于具有较高的技术壁垒,无论在全球还是在中国,内窥镜市场都高度集中。在全球,奥林巴斯、富士、宾得三家日本企业引领了软镜市场,卡尔史托斯、奥林巴斯、史赛克引领了硬镜市场。
近几年,我国内镜市场的国产化率得到了明显提高,外资垄断程度有所下降。软镜市场中,2018~2021年间,开立和澳华的内镜收入分别达到40.4%和30.7%的复合年增长率,2022年时开立超过宾得成为了国内市占率第三的软镜品牌;硬镜市场中,2022年迈瑞超过史赛克成为了市占率第三,欧谱曼迪则在荧光内镜市场中占有一半的市场份额。
2.1 整体市场:市场集中度高,中国相较全球增速更快
医用内窥镜是全球医疗器械市场中增长较快的板块之一。根据沙利文咨询,2020年全球医用内窥镜的市场规模为203亿美元,预估到2025年将增至286亿美元,2020年到2025年的复合增长率为7.1%。

全球医用内窥镜市场的集中度较高。按2020年的产品销售收入计,前三大内窥镜厂商奥林巴斯、卡尔史托斯及史赛克共占有全球市场份额的42.3%。其中,奥林巴斯以23.6%的市场份额领先,其次是卡尔史托斯及史赛克,市场份额分别为10.3%和8.4%。按照产品大类划分,在全球内窥镜市场中,硬镜、软镜、设备和附件市场占比差别不大,其中软镜占比最高为27.6%,硬镜为22.2%,设备为24.2%,附件为26.0%。

中国的医用内窥镜市场相较全球增速更快。根据沙利文咨询,2020年中国医用内窥镜的市场规模为131亿元,预估于2024年增至188亿元,2020年到2024年的复合增长率为9.45%。
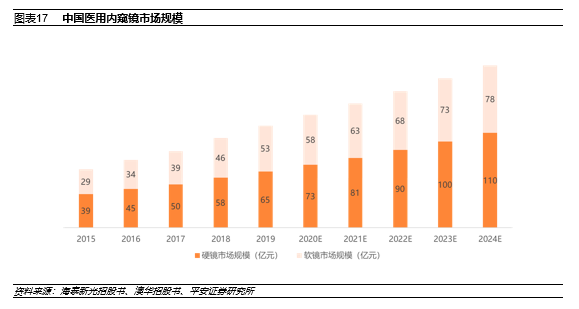
2.2 中国软镜市场:奥巴依旧引领,开立澳华初露头角
2018年,中国软镜市场呈现外资绝对垄断的状态,奥林巴斯、富士胶片和宾得三家日本企业的市场份额合计90%以上,国产企业澳华、开立的市场份额均不到3%。2018~2021年间,开立和澳华内窥镜收入的复合年增长率分别达到40.4%和30.7%,远超行业平均增速。2022年时,两家国产企业的市场份额均有提升,其中开立成为了中国软镜市场上市占率第三的品牌。
面对外资垄断的中国三级医院市场,开立和澳华在近几年推出了各自的高端产品线:开立在2018~2019年间推出HD550高清内窥镜系统,2021年和2022年分别推出环阵超声内镜EG-UR5与凸阵超声内镜EG-UC5T。澳华在2018年推出AQ-200高清内窥镜系统,2022年推出了新一代的AQ-300 4K超高清内窥镜系统。

2.3 中国硬镜市场:Storz、奥巴领先,迈瑞快速发展
2018年我国硬镜市场上,卡尔史托斯、奥林巴斯、史赛克三家外资企业合计占据83%的市场份额。国产硬镜企业主要有沈阳沈大、浙江天松等,所占市场份额合计不到10%,且产品处于低端市场。2022年,随着迈瑞等国产企业的入局,外资三巨头的市场份额下降至66.1%。
迈瑞2017年推出1080P高清内窥镜摄像系统,2020年推出4K白光内窥镜摄像系统,经过几年发展,2021年起成为中国硬镜市场上中标数量排名第3的企业。而欧谱曼迪抓住了荧光内镜的发展机遇,在中国硬镜市场上也具有了一席之位。

2.4 中国内镜企业发展现状:上游技术趋于成熟,市场教育和售后服务仍有进步空间
国产内镜企业在近几年实现了快速发展,这与内窥镜上游技术趋于成熟有着密不可分的关系。
我国内窥镜行业在发展初期,市场规模较小,上游厂家的研发动力不足;而随着临床需求的持续增长,行业景气度大大提升,内窥镜上游的各个技术环节被一一突破,为国产内窥镜企业快速发展提供了条件。

国产企业在发展初期,多数只具备研发或生产其中某一部件的能力;在不断发展的过程中,国产企业逐步完善了从内窥镜部件到整机系统的布局,或进一步入局配套的诊疗耗材。

目前国产企业中的领头羊已经基本攻克了内镜研发制造的多道技术壁垒,产品性能逐步提升,产品线逐渐完善。但由于进入市场较晚,国产内镜企业在一些方面与外资企业仍有差距,如产品的耐用性、稳定性,市场教育、售后服务等。国产企业仍需不断打磨产品,增加市场投入,才能树立优良的品牌形象,进一步实现国产替代。

03 内镜技术参数不断升级,复合成像与一次性内镜成为创新重点
面对行业发展机遇,国产内窥镜企业在新技术研发和新产品布局上表现得十分积极,紧追外资企业创新步伐。
一方面,内窥镜图像不断升级,清晰度由高清升级为4K,并逐步探索3D的应用;另一方面,复合成像技术得到发展,荧光内镜、超声内镜、共聚焦显微内镜等产品满足了更多临床需求。在产品形式上,一次性内镜在某些领域表现出特有优势。

3.1 硬镜新趋势:4K荧光布局者众多,3D认可度日益提升
在硬镜市场中,荧光内镜的市场份额逐年增长,3D的临床认可度也有所提升。
荧光技术提高了对于靶向器官的可视性,尤其在普外科、肝胆科、妇科等临床科室中具有显著优势。相较白光内镜,荧光内镜的成像深度更深,不仅可以观察人体组织表面,还可以观察到表层以下的组织(如胆囊管、淋巴管、血管),因此在手术中可以对病灶或周围组织进行更准确的显影,提高手术精准度。

中国荧光内镜在发展初期市场规模较小,但未来在硬镜中的市场份额将逐年提高。荧光内镜发展至今,行业更倾向把荧光成像看作传统白光内镜的一个附加功能,二者并非替代关系。随着医生对荧光临床价值的认可度不断提升,终端医疗机构在适用于荧光内镜的手术场景下,会更有意愿采购荧光内窥镜整机系统。
据沙利文咨询,2019年全球荧光硬镜的市场规模达到13.1亿美元,占总体硬镜市场的比重为22.9%;预计未来将呈现高速增长,以24.3%的年复合增长率增长至2024年的38.7亿美元,占比提高至53.5%。在中国,2019年荧光内镜的市场规模仅有1亿多,占硬镜市场中的比重不足2%。未来,随着国内外企业推出更加成熟的荧光内镜产品,以及医生接受度明显提高,荧光内镜将持续高速发展,预计能够占据我国硬镜市场至少30%的市场份额。
在全球荧光内镜市场上,史赛克占据主导地位。2019年,史赛克的销售额达10.23亿美元,市场占比为78.4%;卡尔史托斯和德国狼牌以1.26亿美元和0.53亿美元的销售额排名第二和第三位,市场占比分别为9.6%和4.1%。

在中国市场上,由于史赛克新产品的缺位,国产企业占据荧光内镜半壁江山。史赛克的荧光内镜系统1588于2016年初在北美上市,是当时史赛克在全球主推的机型,原计划3年后在中国完成上市。在申请NMPA注册的过程中,1588的摄像系统于2018年6月获批,然而配套的荧光光源由于应用了史赛克的独家技术,需要进行额外的人体临床试验,耗时较久,导致该系统未能如期在中国上市。2022年5月,史赛克1688 4K荧光内镜系统的配套荧光光源获批NMPA,至此,史赛克的4K荧光内镜系统才可以开始在中国进行销售。
在2019年的中国市场上,仅有2款荧光内镜系统获批,其一来自史赛克收购的Novadaq,其二来自国产企业欧谱曼迪。根据沙利文咨询,2019年,Novadaq和欧谱曼迪分别以5700万元人民币和5390万元人民币的销售额占据当年我国荧光内镜市场51.4%和48.6%的份额。
2021~2022年间,国产荧光内镜产品获批数量快速增长。截至目前,已有近20家国产企业的荧光内镜产品获得NMPA批准。

在国产企业纷纷布局荧光内镜的同时,外资巨头的新品上市计划也在进行中。
2021年11月、2022年5月,史赛克1688 4K荧光内镜系统和配套的荧光光源分别获批NMPA,该系统拥有多种成像模式,为医生提供更清晰直观的手术图像。在1688之后,史赛克具有6路光源(RGB三原色光+荧光+NBI光源+分子探针光源)的最新荧光内镜产品1788也即将在全球上市。

4K荧光内镜的布局者众多,最终哪家企业可以在激烈的市场竞争中获得更多市场份额,需要同时考量企业的产品性能与市场渠道能力。
在布局4K荧光成为硬镜企业主流选择的同时,3D成像在国内的热度也逐渐高涨。与传统2D腹腔镜相比,3D腹腔镜可提供手术视野的三维立体感和手术操作的空间纵深感。受过去设备和技术等客观条件的限制,3D图像分辨率低,使用者易产生视觉疲劳和不适感,严重影响其在临床的推广。近年来,随着技术的不断发展,上述缺陷获得极大改善,3D腹腔镜手术正逐步获得广大外科医师的认可。

国产企业新光维和外资企业卡尔史托斯、奥林巴斯最早在中国上市了3D内窥镜产品,但其市场推广受到了临床认可不足及产品价格较高的限制。随着更多国内外企业的入局,3D内镜的临床教育将在中国市场获得加强;而国内公司的本土化生产,将使得3D内镜的成本明显降低。

硬镜市场领军者卡尔史托斯,推出的最新硬镜系统为Rubina 3D+4K荧光内镜,将3D、4K和荧光三大功能结合于一体,目前正在NMPA注册流程中。

3.2 软镜新趋势:国产4K高清内镜、超声内镜上市,缩小与进口差距
软镜的主要技术发展趋势,一方面是图像性能不断优化并结合AI辅助诊断,另一方面是发展复合成像技术。
2020年,奥林巴宣布推出具备4K高清图像的EVIS X1内窥镜系统,该系统使用了多项图像端的新技术并结合AI程序,帮助医生更高效准确地发现早期癌变。目前该系统正在NMPA注册流程中。
2022年11月,国产企业澳华发布新产品AQ-300 4K超高清内镜系统,成为中国市场上首家推出4K图像的软镜企业,该系统同样具有AI辅助诊断功能,澳华计划借这一新品打开三级医院的市场。

软镜的另一发展趋势是应用复合成像技术,近年来,国内外企业相继推出了超声内镜和共聚焦显微内镜。
对比常规的电子软镜,超声探头的成像深度更深,可以观察消化道表层黏膜以下和消化道外邻近器官的生理状态;而共聚焦显微摄像仪的放大倍数和分辨率更高,可以实现在体的“光学活检”,省去了离体活检为病人造成的身体损伤和等待时间。

超声内镜的市场份额占整个软镜市场的12%左右。2019年,开立医疗的环阵超声内镜EG-UR5与凸阵超声内镜EG-UC5T相继获得欧盟CE认证,是继奥林巴斯、富士与宾得日本三大内镜厂商之后,全球第四家掌握超声内镜关键技术的企业。这两款超声内镜产品于2021年和2022年相继获批NMPA。
在共聚焦显微内镜的研发上,世界上首个商业化的共聚焦显微内镜由日本宾得公司于2006年推出。国内企业海泰新光、精微视达、海斯凯尔的共聚焦显微影像仪/微探头影像仪在2019~2022年间陆续获批NMPA。目前共聚显微内窥镜主要与消化道和呼吸道内窥镜配合使用。
但是现阶段,这两项复合成像技术都未被明确写入中国相关临床指南,其未来发展需要大量的市场教育作为铺垫。
3.3 一次性内镜:市场迅速爆发,补充复用式内镜市场
一次性内镜是对复用式内镜的补充,在某些科室和某些诊疗场景下显示出了临床价值。一次性内镜是将内窥镜“设备耗材化”的新产品模式。一次性内镜单次使用,无需清洗,杜绝了传统复用式内镜在临床上可能出现的因消毒杀菌不彻底而导致的感染事件。
复用式内镜龙头企业的技术经验和渠道资源并不能直接复制到一次性内镜市场而形成护城河。一次性内镜与传统复用式内镜的技术方案存在较大差异,两类产品的构造、材料、应用场景均有差异。奥林巴斯、卡尔史托斯、史赛克等传统内镜龙头企业也未重点发力一次性内镜市场,均在2019年后获批首款一次性内窥镜。

2020年,全球一次性内镜市场高度集中,Ambu与波士顿科学的全球市占率分别为57.3%和19.1%。当年的中国市场也呈现同样特点,Ambu、幸福工场及普生医疗共占国内总市场份额的91.2%,三家市场份额分别为35.7%、29.2%和26.2%。
2020年后,国内迎来了一次性内镜企业的集体爆发。自Ambu(一次性支气管内镜)和波科(一次性胆胰管、输尿管肾盂内镜)的一次性内镜分别于2015年和2017年获批NMPA后,2020~2022年间,共有至少69款国产一次性内镜产品在国内上市。

不同科室一次性内镜的应用前景存在差异,这导致我国不同科室一次性内镜产品的注册数量存在很大差异:
泌尿科一次性内镜的潜力较高,国产企业布局者众多,原因在于泌尿科内镜在手术中有很大的损坏概率,且手术收费较高,为一次性产品提供了较高的价格空间;
消化科一次性内镜的应用较少,原因在于消化内镜筛查对内镜图像有较高要求且我国暂未出现严重的消化内镜感染事件;
呼吸科一次性支气管镜符合了新冠疫情的特殊需求,主要应用场景为重症ICU、床旁急诊术以及胸外科手术中。
一次性内镜作为一种新的产品形式,为行业开辟出了一条崭新的细分赛道。全球一次性内镜龙头Ambu在呼吸科、泌尿科、耳鼻喉和消化科4个科室均有产品布局。

在2020/21财年(2020.10.1~2021.9.30),Ambu收入实现16%的有机增长,一次性支气管镜在 COVID-19治疗中发挥重要作用的同时,一次性膀胱镜和耳鼻喉镜也实现快速增长。
在2021/22财年(2021.10.1~2022.9.30),公司收入有机增长4%,其中膀胱镜和耳鼻喉镜保持增长,而支气管镜由于市场已有库存较多以及市场竞争加剧,销售产生下降。
消化科内镜由于临床上相关诊疗过程较复杂,目前医生对一次性内镜产品的认可度不高,产品放量速度较缓。

04国内外主要内镜企业概览
4.1 奥林巴斯
日本企业奥林巴斯是全球内窥镜市场的领军企业,成立于1919年,以显微镜等光学仪器起家。1950年,奥林巴斯推出世界上第一台胃内照相机,进入了软镜领域,1975年又进入了硬镜领域。
2006年,奥林巴斯将窄带成像(NBI)技术应用于内镜诊断,可以清晰观察到普通内镜观察不到的微小血管结构(毛细血管、集合小静脉、癌新生血管等)及黏膜表面微细结构(隐窝边缘上皮、隐窝开口、隐窝间部等)。2015年,奥林巴斯与索尼的合资企业SOMED发布了全球首款具有4K分辨率的硬镜系统VISERA 4K UHD。2017年,奥林巴斯发布VISERA ELITE II 硬镜系统,同时具有3D和荧光功能。2020年,奥林巴斯发布EVIS X1 4K软镜系统,在应用NBI等多种图像处理技术的同时也增加了AI辅助诊断的功能。
2022年,奥林巴斯发布最新的硬镜系统VISERA ELITE III,将4K、3D、荧光成像和NBI窄带成像技术合于一身。

2022财年(2021.4.1~2022.3.31),奥林巴斯全球营收为8689亿日元(77.31亿美元),医疗业务占比85%,包含内窥镜业务和与内窥镜搭配的手术治疗器械业务。
在内窥镜业务中,消化内镜、内镜维修费、外科内镜的收入占比分别为55%、30%、15%左右,即分别为22.5、12.3、6.1亿美元左右。

中国是继北美、欧洲、日本后,奥林巴斯在全球的第四大市场。自2020财年起,奥林巴斯开始单独披露中国区收入数据。按人民币记,2020财年,奥林巴斯内窥镜业务在中国区的收入实现28.1%的同比增长。2020财年之后,受到中国本土企业的冲击,奥林巴斯中国区内镜收入增长放缓。2019~2022财年期间,其中国区内镜收入的年复合增长率约6%。

EVIS X1是奥林巴斯目前最重要的消化内镜系统,2022财年在该产品上市的地区,公司消化内镜业务中约23%的收入来自EVIS X1。未来公司计划继续扩大EVIS X1的销售,并准备在美国和中国等市场推出该产品。此外,公司准备推出下一代超声内镜系统,并开发一次性十二指肠镜。在外科内镜业务上,公司计划扩大外科内镜系统VISERA ELITE ll的销售,并推动VISERA ELITE lll和荧光内镜ORBEYE的上市。
4.2 开立医疗(300633.SZ):HD-550打开三级医院软镜市场,同时布局硬镜业务
开立成立于2002年,公司主要产品包括医用超声诊断设备、医用电子内窥镜设备及耗材等。
开立同时发展了软镜和硬镜业务:开立分别于2016年和2021年发布首台软镜和硬镜产品,2022年超过宾得成为国内软镜市场市占率第三的企业,位列奥林巴斯和富士之后。

目前,开立最先进的软镜系统是HD-550,于2018年底~2019年初期间推出,在图像处理上应用了其特有的SFI聚谱成像技术和VIST光电复合染色成像技术。
利用在超声技术上的优势,在2021~2022年间,公司相继推出国产首款超声电子上消化道内窥镜和内窥镜用超声诊断设备,打破了外资在超声内镜上的技术垄断。
硬镜方面,开立先后推出高清硬镜SV-M2K30和4K超高清硬镜SV-M4K3,与公司的腹腔镜与胸腔镜搭配组成了整套微创手术内窥镜方案。2022年,公司的荧光硬镜获批NMPA,进一步完善了硬镜上的产品布局。

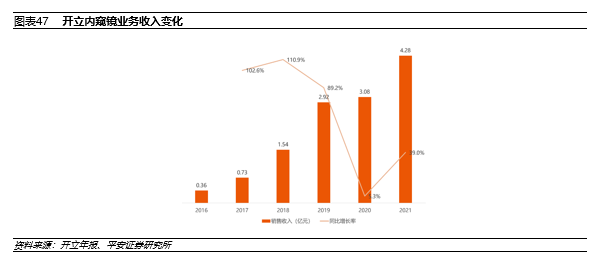
2021年,开立医疗总收入14.45亿元,其中内窥镜及镜下治疗器具收入4.28亿元,占比29.61%,同比增长39.03%,高于整体增长24.20%。内窥镜及镜下治疗器具的毛利率为68.68%。

近五年来,除去2020年疫情影响,其他年份中,开立的内窥镜业务均实现30%以上的同比增长。
在国内市场,开立在2022年上市了多款新产品,包括软镜中的十二指肠镜、鼻咽喉内镜、超声内镜和硬镜中的胸腹腔镜以及荧光内镜。未来企业将持续扩展软镜中的镜体种类,推出130倍光学放大内镜、可变硬度镜体等新镜体,同时加强硬镜和其它外科手术器械的研发,构建企业新的增长曲线。在加速新产品国内市场放量的同时,公司也在推动HD-550系统和腹腔镜的CE注册。
4.3 澳华内镜(688212.SH):聚焦软镜,新品AQ-300技术参数国内领先
澳华成立于1994年,是我国最早开始研发软镜的企业之一。澳华自成立直至今天,业务一直聚焦于软镜,产品不断迭代创新。2013年,AQ-100上市,在图像处理上应用了公司自研的分光染色技术;2018年,AQ-200上市,采用激光传输和无线供电技术保证图像质量稳定;2022年,AQ系列又推出了新产品AQ-300,是中国市场上首款具有4K图像的消化内镜。
2021年,澳华内镜总收入3.47亿元,大部分来自内窥镜设备的销售,内窥镜整体业务毛利率为69.29%。

在过去5年中,澳华在2019年实现了最高的营收增长91.5%,这主要得益于AQ-200的上市和中国消化内镜市场的启蒙。

2022年1月,澳华发布股权激励计划,业绩考核目标为收入端2022~2024年分别不低于4.4、6.6、9.9亿元,净利润端2023、2024 年分别不低于0.8、1.2亿元。即企业的业绩目标为在2023和2024年均实现50%的收入增长。
2022年末,澳华最新的软镜系统AQ-300正式上市,全系统包含4K图像处理器、多LED医用冷光源、检查胃镜、大钳道治疗胃镜、可变硬度肠镜、十二指肠镜、光学放大内镜、双焦内镜、分体一次性肠胃镜、一体一次性肠胃镜,新增多款细镜,是公司未来两年内最重磅的软镜系统。公司正在进行研发的项目包括软镜机器人系统和3D消化道软镜。
4.4 迈瑞医疗(300760.SZ):渠道和品牌优势明显,已成为中国硬镜第三品牌
迈瑞创建于1991年,经过30余年的发展,已经成为了我国规模最大的医疗器械企业。迈瑞有三大主要业务线,生命信息与支持、体外诊断和超声影像设备。
微创外科是迈瑞在近十年内新进入的赛道,和生命信息与支持业务板块有较强的科室协同性。自2017年进入硬镜市场后,迈瑞的硬镜收入和市占率快速提升,产品布局也十分迅速:2020年,公司推出4K白光硬镜;2021年,推出4K荧光硬镜;2022年,推出超声高频集成手术设备。

当前迈瑞已经超过史赛克成为国内硬镜市场上的第三品牌,位列于卡尔史托斯和奥林巴斯之后。2023年,迈瑞新一代4K荧光内镜即将上市,该产品实现了核心成像模块的自研自产,产品性能对标奥林巴斯和卡尔史托斯。与此同时,公司正在与医院、科研院所合作,开发3D内窥镜,预计将于2023年底左右上市。
4.5 海泰新光(688677.SH):与史赛克深度绑定之外,开始发展自主品牌
海泰新光的前身为海泰镀膜,由海泰光电、美国飞锐于2003 年出资设立,主要通过ODM模式销售医用内窥镜和光学产品的上游核心零部件。2019年,为减少关联交易、增强业务的独立性,海泰新光收购了美国飞锐的内窥镜维修业务和内窥镜焊接封装业务。
作为上游零部件提供商,海泰新光超过 70%的收入来自ODM模式。而在2021~2022年间,公司自主品牌的内窥镜产品相继获批NMPA,形成了自主品牌的4K白光和荧光内窥镜系统。

2021年,海泰新光总收入3.10亿元,其中内窥镜收入2.28亿元,占比73.53%,内窥镜业务的毛利率为68.70%。按销售地区拆分,国内收入6276万元,同比增加了 66.3%,主要是因为公司对国内市场的拓展尤其是内窥镜产品在国内的销售持续上升。
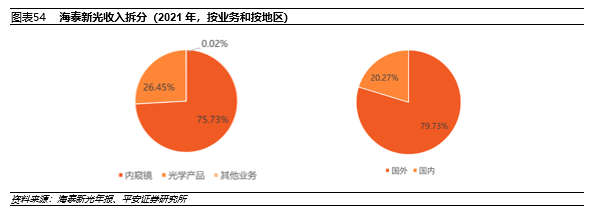
2017~2021年,海泰新光80%左右的收入均来自国外市场,这主要是因为公司荧光内窥镜被美国公司史赛克采购,是史赛克高清荧光腹腔镜整机系统中核心部件的唯一设计及生产供应商,包括高清荧光内窥镜、高清荧光摄像适配镜头和荧光光源。

未来发展战略方面,公司将持续深化ODM业务,同时推进自主品牌产品的销售和研发注册工作。自主品牌产品中,关节镜、宫腔镜、胸腔镜等产品目前处于产品注册阶段,3D荧光腹腔镜以及3D内窥镜摄像系统正处于研发和注册阶段。

站点声明:
本网站所提供的信息仅供参考之用,并不代表本网赞同其观点,也不代表本网对其真实性负责。图片版权归原作者所有,如有侵权请联系我们,我们立刻删除。如有关于作品内容、版权或其它问题请于作品发表后的30日内与本站联系,本网将迅速给您回应并做相关处理。
北京飞速度医疗科技有限公司专注于医疗器械、诊断试剂产品政策与法规规事务服务,提供产品注册申报代理、临床合同(CRO)研究、产品研发、GMP质量辅导等方面的技术外包服务。
上一篇:安徽部署医疗器械生产监管重点任务
ONE-STOP SERVICE
免费赠送3万家医疗器械企业名录